解题方法
1 . 用下列装置进行实验,不能达到实验目的的是
| 选项 | A | B | C | D |
| 实验装置 | 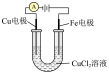 | 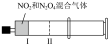 | 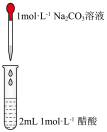 | 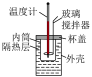 |
| 实验目的 | 铁电极上镀铜 | 探究压强对化学平衡的影响 | 比较 的 的 与 与 的 的 的大小 的大小 | 测定盐酸与NaOH反应的中和热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列反应的离子方程式表示错误的是
A.泡沫灭火器的反应原理: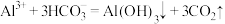 |
B.硝酸银溶液中加入足量稀氨水: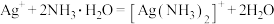 |
C.少量 通入 通入 溶液中: 溶液中: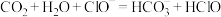 |
D.硫化氢通入 溶液中: 溶液中: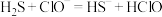 |
您最近一年使用:0次
2024-02-02更新
|
68次组卷
|
2卷引用:山东省济南市2023-2024学年高二上学期1月期末化学试题
3 . 食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫___________ ,乙酸的官能团是___________ (写名称).
(2)实验室常用图装置制备乙酸乙酯.
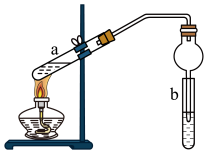
①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是___________ ,浓硫酸的作用是___________ ,a试管中主要反应的化学方程式为______________________________ .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________ .
(3)醋酸能除水垢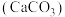 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________________ .
(4) ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
①
___________ ;②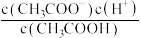
___________ ;③
___________ .
(5)室温下,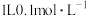 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为___________ .
(1)乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫
(2)实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是
(3)醋酸能除水垢
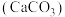 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)
 ,将
,将 的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).
的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①

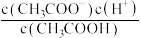

(5)室温下,
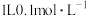 醋酸溶液
醋酸溶液 ,则该温度下醋酸电离平衡常数
,则该温度下醋酸电离平衡常数 ,约为
,约为
您最近一年使用:0次
名校
4 . 按要求完成下列试题:
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,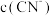
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A. 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填编号)。
③室温下,一定浓度的 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=___________ 。
④将少量 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是___________ 。
(2)室温下, 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中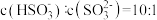 ,溶液的pH=
,溶液的pH=___________ 。(室温下, 的
的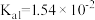 ;
; )
)
II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为_______ ;B的原子核外电子运动状态有_________ 种,
(4)C的最外层电子排布式为________ ;D的原子结构示意图为________ 。
I.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  | HCN |  |
| 电离常数(25℃) |  | 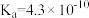 |  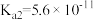 |
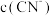
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:A.
 、B.NaCN、C.
、B.NaCN、C. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是③室温下,一定浓度的
 溶液pH=9,溶液中
溶液pH=9,溶液中 =
=④将少量
 通入NaCN溶液,反应的离子方程式是
通入NaCN溶液,反应的离子方程式是(2)室温下,
 通入NaOH溶液中,在所得溶液中
通入NaOH溶液中,在所得溶液中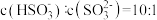 ,溶液的pH=
,溶液的pH= 的
的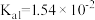 ;
; )
)II.元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(3)A的最外层电子轨道表示式为
(4)C的最外层电子排布式为
您最近一年使用:0次
名校
5 . 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH由小到大排列的顺序是___________ 。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol·L−1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___________
A.c(H+) B. C.c(H+)·c(OH−) D.
C.c(H+)·c(OH−) D. E.
E.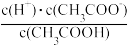
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(4)25℃时,将amol·L−1的醋酸溶液与bmol·L−1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=___________ (用含a、b的代数式表示)。
(5)1mol·L−1的Na2CO3溶液中,用溶液中微粒的浓度符号完成下列等式:cOH−=2cH2CO3+___________ 。
(6)25℃时,等物质的量浓度的HClO与NaClO等体积混合,混合溶液显___________ 性(填“酸”、“碱”或“中”);c(ClO-)___________ c(HClO)(填“>”、“<”或“=”);该溶液中所含的四种离子浓度由大到小的顺序为___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.810−5 | Kal=4.310−7、Ka2=5.610−11 | Ka=3.010−8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol·L−1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.c(H+) B.
 C.c(H+)·c(OH−) D.
C.c(H+)·c(OH−) D. E.
E.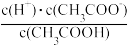
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将amol·L−1的醋酸溶液与bmol·L−1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=
(5)1mol·L−1的Na2CO3溶液中,用溶液中微粒的浓度符号完成下列等式:cOH−=2cH2CO3+
(6)25℃时,等物质的量浓度的HClO与NaClO等体积混合,混合溶液显
您最近一年使用:0次
6 . 回答下列问题
(1)下列物质中属于强电解质的是___________ (填序号)。
①稀硫酸 ②硫酸钡 ③熔融氯化钠 ④氯水 ⑤醋酸铵
(2)已知水的电离平衡曲线如图所示。
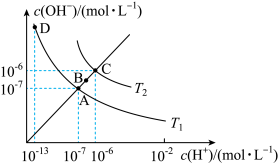
①写出使A点变为B点的措施:___________ ,采取该措施的原因是___________ 。
②向水中滴加适量NaOH溶液可实现A点→D点的变化,则D点对应溶液的pH为___________ 。
③ ℃时,
℃时, 的NaOH溶液中
的NaOH溶液中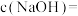
___________ ,若向该溶液中滴加 盐酸使溶液呈中性,则所用溶液的体积比
盐酸使溶液呈中性,则所用溶液的体积比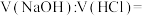
___________ 。
(3)常温下,碳酸的电离平衡常数为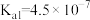 、
、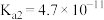 ;次氯酸的电离平衡常数
;次氯酸的电离平衡常数 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(1)下列物质中属于强电解质的是
①稀硫酸 ②硫酸钡 ③熔融氯化钠 ④氯水 ⑤醋酸铵
(2)已知水的电离平衡曲线如图所示。

①写出使A点变为B点的措施:
②向水中滴加适量NaOH溶液可实现A点→D点的变化,则D点对应溶液的pH为
③
 ℃时,
℃时, 的NaOH溶液中
的NaOH溶液中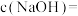
 盐酸使溶液呈中性,则所用溶液的体积比
盐酸使溶液呈中性,则所用溶液的体积比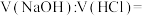
(3)常温下,碳酸的电离平衡常数为
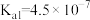 、
、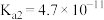 ;次氯酸的电离平衡常数
;次氯酸的电离平衡常数 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次
名校
7 .  时,
时, 的电离常数
的电离常数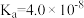 ,
, 的电离常数
的电离常数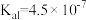 、
、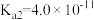 。下列说法
。下列说法不正确 的是
 时,
时, 的电离常数
的电离常数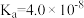 ,
, 的电离常数
的电离常数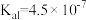 、
、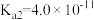 。下列说法
。下列说法A. 溶液和 溶液和 溶液中离子种类相同 溶液中离子种类相同 |
B. 时,反应 时,反应 的 的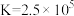 |
C. ,物质的量浓度相同的 ,物质的量浓度相同的 溶液与 溶液与 溶液的 溶液的 :前者小于后者 :前者小于后者 |
D.向氯水中加入少量 固体, 固体, 增大 增大 |
您最近一年使用:0次
2023-05-07更新
|
552次组卷
|
3卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
名校
8 .  与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。
(1)人体血液中存在平衡 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:_______ 。
(2)利用 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题:
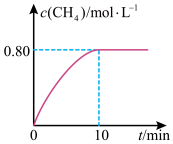
①下列说法正确的是_______ 。
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L
②从反应开始到10min, 的平均反应速率
的平均反应速率
_______ 。
③300℃时,反应的平衡常数K=_______ 。
④500℃该反应达到平衡时,上述容器中有1.6mol 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。
则
_______ 0(填“>”“<”或“=”)
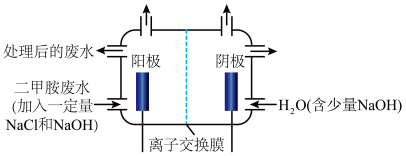
(3)化工废水中常常含有以二甲胺(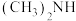 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
反应原理是:(i) 在阳极转化为
在阳极转化为 ;
;
(ii) 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;
(iii) 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。
①写出电解池中阴极发生反应的方程式_______ 。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是_______ 。
③当阴极区收集到6.72L(标况下) 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是_______ L。
 与人类息息相关。近年来,为了缓解温室效应,
与人类息息相关。近年来,为了缓解温室效应, 的资源化利用是化学研究热点之一。科学家提出了多种回收和利用
的资源化利用是化学研究热点之一。科学家提出了多种回收和利用 的方案。
的方案。(1)人体血液中存在平衡
 ,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:
,当人呼吸过快或过深,体内失去二氧化碳太多,引发呼吸性碱中毒,导致手脚发麻、头晕。试用平衡移动原理解释上述现象:(2)利用
 制备
制备 可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol
可以实现变废为宝,300℃时,向2L恒容密闭容器中充入2mol 和8mol
和8mol 发生反应:
发生反应:
 ,混合气体中
,混合气体中 的浓度与反应时间的关系如图所示,回答下列问题:
的浓度与反应时间的关系如图所示,回答下列问题:
①下列说法正确的是
A.容器内密度不变,说明反应达到平衡状态
B.容器内压强不变,说明反应达到平衡状态
C.断开2mol C=O键的同时断开4mol C-H键,说明反应达到平衡状态
D.300℃时,向平衡后的容器中再充入2mol
 和8mol
和8mol ,重新达到平衡时
,重新达到平衡时 的浓度小于1.6mol/L
的浓度小于1.6mol/L②从反应开始到10min,
 的平均反应速率
的平均反应速率
③300℃时,反应的平衡常数K=
④500℃该反应达到平衡时,上述容器中有1.6mol
 、2.0mol
、2.0mol 、5.6mol
、5.6mol 、4.0mol
、4.0mol 。
。则

(3)化工废水中常常含有以二甲胺(
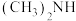 )为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
)为代表的含氮有机物,可以通过电解法将二甲胺转化为无毒无害的气体排放,装置如图所示。
反应原理是:(i)
 在阳极转化为
在阳极转化为 ;
;(ii)
 在碱性溶液中歧化为
在碱性溶液中歧化为 ;
;(iii)
 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和 。
。①写出电解池中阴极发生反应的方程式
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到6.72L(标况下)
 时,阳极区收集到
时,阳极区收集到 的体积(标况下)是
的体积(标况下)是
您最近一年使用:0次
名校
9 . 下列实验操作、现象、结论均正确的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 将铜与浓 反应生成的气体收集后用冰水混合物冷却 反应生成的气体收集后用冰水混合物冷却 | 气体颜色加深 |   |
| B | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 溶液颜色变浅 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 取2mL0.1mol/L 溶液,先滴加3滴0.1mol/LNaCl溶液,后滴加5滴0.1mol/LKI溶液,观察沉淀情况 溶液,先滴加3滴0.1mol/LNaCl溶液,后滴加5滴0.1mol/LKI溶液,观察沉淀情况 | 先生成白色沉淀,后变为黄色沉淀 | 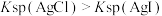 |
| D | 已知 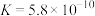  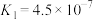  ,向饱和硼酸溶液中滴加碳酸钠溶液 ,向饱和硼酸溶液中滴加碳酸钠溶液 | 无明显现象 |  与碳酸钠不反应 与碳酸钠不反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-17更新
|
238次组卷
|
2卷引用:广东省揭阳市揭东区2022-2023学年高二上学期期末考试化学试题
名校
10 . 化学平衡常数是表明化学反应限度的一个特征值,由下表中的数据不能 得出的结论是
| 弱酸 | HCOOH | HCN |  |
| 电离平衡常数(25℃) | 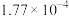 |  |  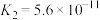 |
A. |
B. |
C. |
D.等浓度的HCOONa溶液和NaCN溶液中, |
您最近一年使用:0次
2023-02-11更新
|
241次组卷
|
3卷引用:广东省深圳罗湖区202-2023学年高二上学期期末质量检测化学试题



