名校
解题方法
1 .  为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含
为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含 ,及少量
,及少量 、
、 、
、 等杂质)经过加工处理,可制得
等杂质)经过加工处理,可制得 晶体。其实验步骤如下:
晶体。其实验步骤如下:
I.样品分解:称取a g毒重石矿粉于烧杯中,加入稍过量的 溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
II.除 :向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
:向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
III.结晶:将步骤II的 滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
回答下列问题:
(1)步骤I中,观察到的实验现象有___________ 。
(2)步骤II检验 是否完全沉淀的方法是
是否完全沉淀的方法是___________ ;在过滤中,下列仪器必需用到的是___________ (填仪器名称),与普通过滤相比,步骤III抽滤的优点是___________ 。___________ ,___________ ,抽滤”。
(4)样品分解时,不选用酸性更强且等量的盐酸溶液替代 溶液,可能的原因是
溶液,可能的原因是___________ 。
(5) 纯度的测定
纯度的测定
某学生查阅资料: ,X代表
,X代表 ,
, 、
、 等,
等, 代表
代表 的阴离子,设计如下纯度测量方案:
的阴离子,设计如下纯度测量方案:
步骤I.准确称取 粗品并用20.0mL水溶解。
粗品并用20.0mL水溶解。
步骤II.用 的
的 标准溶液滴定其中的
标准溶液滴定其中的
步骤III.重复滴定2~3次,记录每次消耗 标准溶液的体积
标准溶液的体积
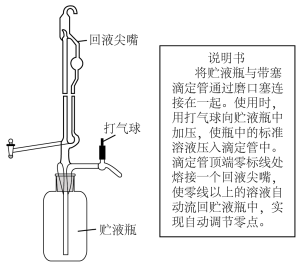
①滴定时采用下图所示的侧边自动定零位滴定管,结合该装置的使用说明书分析其优点___________ 。 含量的测定值偏高的是
含量的测定值偏高的是___________ (填序号)。
a.未干燥锥形瓶 b. 标准溶液久置部分失效
标准溶液久置部分失效
c.滴定终点时滴定管尖嘴中产生气泡 d.杂质可与 反应
反应
 为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含
为无色结晶,有毒;水中的溶解度为35.7g(20℃)、58.7g(100℃)。实验室用毒重石(主要含 ,及少量
,及少量 、
、 、
、 等杂质)经过加工处理,可制得
等杂质)经过加工处理,可制得 晶体。其实验步骤如下:
晶体。其实验步骤如下:I.样品分解:称取a g毒重石矿粉于烧杯中,加入稍过量的
 溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。
溶液,90℃下加热搅拌2h,待充分反应后,冷却,过滤。II.除
 :向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。
:向滤液中加入一定量的BaS溶液,有黑色沉淀生成,过滤。III.结晶:将步骤II的
 滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。
滤液经过___________,___________,抽滤,用冷水和乙醇各洗涤晶体2~3次,自然晾干。回答下列问题:
(1)步骤I中,观察到的实验现象有
(2)步骤II检验
 是否完全沉淀的方法是
是否完全沉淀的方法是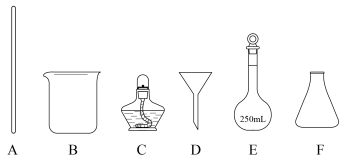
(4)样品分解时,不选用酸性更强且等量的盐酸溶液替代
 溶液,可能的原因是
溶液,可能的原因是(5)
 纯度的测定
纯度的测定某学生查阅资料:
 ,X代表
,X代表 ,
, 、
、 等,
等, 代表
代表 的阴离子,设计如下纯度测量方案:
的阴离子,设计如下纯度测量方案:步骤I.准确称取
 粗品并用20.0mL水溶解。
粗品并用20.0mL水溶解。步骤II.用
 的
的 标准溶液滴定其中的
标准溶液滴定其中的
步骤III.重复滴定2~3次,记录每次消耗
 标准溶液的体积
标准溶液的体积①滴定时采用下图所示的侧边自动定零位滴定管,结合该装置的使用说明书分析其优点
 含量的测定值偏高的是
含量的测定值偏高的是a.未干燥锥形瓶 b.
 标准溶液久置部分失效
标准溶液久置部分失效c.滴定终点时滴定管尖嘴中产生气泡 d.杂质可与
 反应
反应
您最近一年使用:0次
2024-03-29更新
|
241次组卷
|
3卷引用:湖南省长沙市第一中学2023-2024学年高三下学期三模化学试题
(已下线)湖南省长沙市第一中学2023-2024学年高三下学期三模化学试题2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学四川省乐山市2024届高三第二次调查研究考试理科综合-化学试题
名校
解题方法
2 . 氧化钪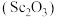 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为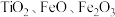 ,还含有
,还含有 等元素)中提取
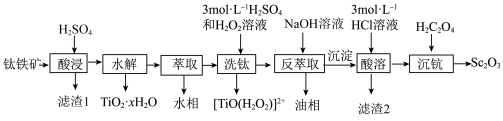
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③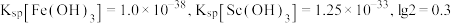 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取 的反应原理为阳离子交换:
的反应原理为阳离子交换: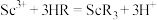 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子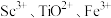 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由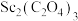 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式_______ 。
 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为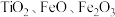 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
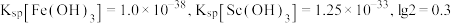 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
 的反应原理为阳离子交换:
的反应原理为阳离子交换: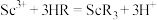 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
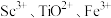 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
301次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8。Z与X形成的阴离子结构如图所示。下列说法中不正确的是
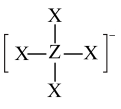
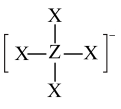
| A.原子半径:Z>W>X |
| B.Y、W的氧化物对应的水化物均为强酸 |
| C.Z与W组成的化合物的水溶液呈酸性 |
| D.工业上常用电解法制备Z的单质 |
您最近一年使用:0次
2023-06-18更新
|
495次组卷
|
2卷引用:湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题
名校
解题方法
4 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验1.探究Na2CS3的性质:
(1)H2CS3是___________ (填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移___________ mol 电子。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:___________ 。
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。
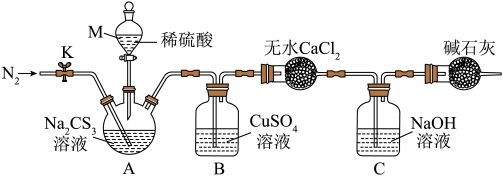
已知: +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___________ ;反应开始前需要先通入一段时间N2,其作用为___________ 。
(5)B中发生反应的离子方程式为___________ 。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___________ 、干燥, 若B中生成沉淀的质量为8.4 g,则Na2CS3溶液的物质的量浓度是___________ mol·L-1。
实验1.探究Na2CS3的性质:
| 步骤 | 操作及现象 |
| ① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
| ② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
| ③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(2)已知步骤③中反应的氧化产物是
 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。

已知:
 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)(4)仪器M的名称是
(5)B中发生反应的离子方程式为
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是
您最近一年使用:0次
2023-05-04更新
|
349次组卷
|
3卷引用:湖南省常德市安乡县第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
5 . 下列离子能大量存在于指定溶液中的是
A.某中性溶液中: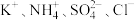 |
B.能使Al粉转化为 的溶液: 的溶液: |
C.能使pH试纸变深蓝色的溶液: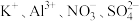 |
D.遇KSCN显红色的溶液: |
您最近一年使用:0次
名校
解题方法
6 . 下列叙述中不正确的是
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应: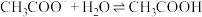 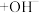 ,使溶液中 ,使溶液中 |
B.常温下,10 0.02 0.02 盐酸与10 盐酸与10 0.02 0.02  溶液混合,若混合后溶液的体积为20 溶液混合,若混合后溶液的体积为20 ,则溶液的 ,则溶液的 |
C.0.1  溶液中: 溶液中: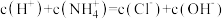 |
D.浓度均为1 的 的 溶液与盐酸等体积混合,混合溶液中: 溶液与盐酸等体积混合,混合溶液中: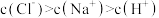  |
您最近一年使用:0次
2023-02-15更新
|
182次组卷
|
6卷引用:湖南省长沙市第一中学2017-2018学年高二上学期期中考试化学试题
名校
7 . 常温下, 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
 的溶液A中含有
的溶液A中含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的四种,且溶液中各离子的浓度均为0.1
中的四种,且溶液中各离子的浓度均为0.1 。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是
。现取该溶液进行有关实验,实验结果如图所示。下列有关说法正确的是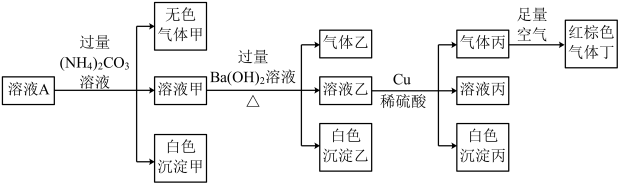
A.溶液A中一定含有 、 、 、 、 、 、 |
B.若实验消耗 14.4g,则生成气体丁的体积为3.36L 14.4g,则生成气体丁的体积为3.36L |
C.沉淀乙中一定有 ,可能有 ,可能有 |
D.溶液A中一定没有 ,但是无法确定是否含有 ,但是无法确定是否含有 |
您最近一年使用:0次
2023-02-08更新
|
242次组卷
|
17卷引用:湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题
湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题湖南省常德市第一中学 2023届高三7月摸底考试化学试题湖南省永州市祁阳县第四中学2023-2024学年高三上学期第三次段考化学试题河南省豫南豫北名校2018届高三精英联赛化学试题1江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题(已下线)黄金30题系列 高三化学 小题易丢分陕西省陕师大附中2018届高三第五次月考化学试题河南省南阳市第一中学校2018届高三第七次考试理综化学试题河北省定州中学2018届高三(承智班)下学期开学考试化学试题河南省豫南豫北名校2018届高三精英联赛化学试题2西藏自治区拉萨中学2018届高三第六次月考理综化学试题安徽省名校2020-2021学年高二下学期5月第二次联考化学试题陕西省西安中学2021-2022学年高三上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)易错点03 离子反应-备战2023年高考化学考试易错题(已下线)学科特色6 离子推断
解题方法
8 . 钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁( ),还含有少量
),还含有少量 ]为原料制备钛的工艺流程如图所示。
]为原料制备钛的工艺流程如图所示。
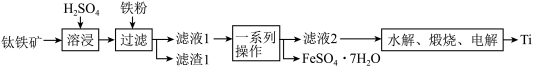
已知:“溶浸”过程中的主要反应为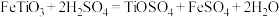 。
。
(1)写出两个加快“溶浸”速率的方法:_______ 。
(2)加入铁粉的目的是_______ 。
(3) 可用于治疗缺铁性贫血,常温下,其溶液呈
可用于治疗缺铁性贫血,常温下,其溶液呈_______ (填“酸”、“碱”或“中”性,实验室配制该溶液时常加入铁粉和_______ (填试剂名称),加入该试剂的目的是_______ 。
(4)若“水解”生成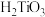 沉淀,则该反应的离子方程式为
沉淀,则该反应的离子方程式为_______ 。
(5)若取10kg钛铁矿( 的质量分数为96%),经过上述流程(Ti元素在整个流程中的损失率为5%),则可制得金属Ti的质量为
的质量分数为96%),经过上述流程(Ti元素在整个流程中的损失率为5%),则可制得金属Ti的质量为_______ kg。
 ),还含有少量
),还含有少量 ]为原料制备钛的工艺流程如图所示。
]为原料制备钛的工艺流程如图所示。
已知:“溶浸”过程中的主要反应为
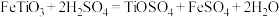 。
。(1)写出两个加快“溶浸”速率的方法:
(2)加入铁粉的目的是
(3)
 可用于治疗缺铁性贫血,常温下,其溶液呈
可用于治疗缺铁性贫血,常温下,其溶液呈(4)若“水解”生成
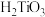 沉淀,则该反应的离子方程式为
沉淀,则该反应的离子方程式为(5)若取10kg钛铁矿(
 的质量分数为96%),经过上述流程(Ti元素在整个流程中的损失率为5%),则可制得金属Ti的质量为
的质量分数为96%),经过上述流程(Ti元素在整个流程中的损失率为5%),则可制得金属Ti的质量为
您最近一年使用:0次
名校
9 . 叠氮化合物是重要的有机合成试剂,实验室制备KN3流程如图。
Ⅰ.制备亚硝酸异丙酯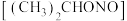
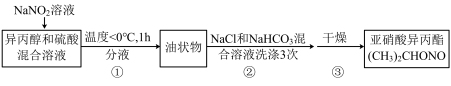
Ⅱ.制备KN3
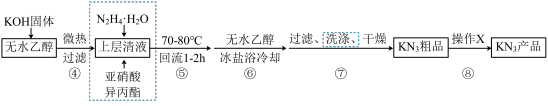
已知:相关物质的性质见下表
回答下列问题:
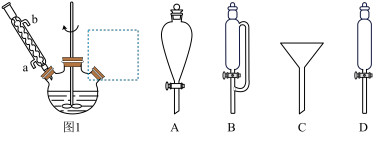
(1)KN3制备装置如图1所示,虚线框中最为合适的仪器是_______ 。(填序号)
(2)步骤②洗涤(CH3)2CHONO使用NaHCO3溶液的主要目的是_______ 。
(3)写出由(CH3)2CHONO、N2H4·H2O和KOH反应生成KN3和(CH3)2CHOH的化学方程式_______ 。
(4)下列说法正确的是_______。(填序号)
Ⅲ.纯度检测-“分光光度法”,其原理:Fe3+与N 反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“N
反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“N 吸光度”曲线确定样品溶液中的c(N
吸光度”曲线确定样品溶液中的c(N )。
)。
查阅文献可知:不同浓度的5.0mLKN3标准溶液,分别加入5.0mL(足量)FeCl3标准溶液,摇匀后测量吸光度,可绘制标准溶液的c(N )与吸光度的关系曲线图如图。
)与吸光度的关系曲线图如图。

纯度检测步骤如下:
①准确称量mgFeCl3·6H2O晶体,配制100mLFeCl3标准液(与文献浓度一致)。
②准确称量0.54gKN3样品,配制成100mL溶液,取5.0mL待测溶液加入VmL(足量)FeCl3标准液,摇匀后测得吸光度为0.6。
(5)配制FeCl3标准液:将mgFeCl3·6H2O晶体放入洁净的烧杯,_______ ,玻璃棒充分搅拌,再加水稀释,冷却后转移至100mL容量瓶。
(6)步骤中②中取用FeCl3标准液V=_______ mL,样品的质量分数为_______ 。(保留两位有效数字)
Ⅰ.制备亚硝酸异丙酯
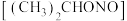

Ⅱ.制备KN3
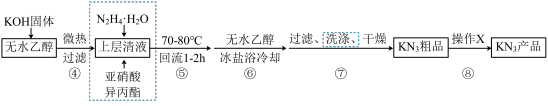
已知:相关物质的性质见下表
| 物质 | 颜色、状态 | 沸点 | 溶解性 |
| KN3 | 无色晶体 | 300℃,受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
| (CH3)2CHOH | 无色液体 | 82℃ | 微溶于水,与乙醇、乙醚混溶 |
| (CH3)2CHONO | 无色油状液体 | 39℃ | 不溶于水,与乙醇、乙醚混溶 |
| N2H4·H2O | 无色油状液体 | 118℃ | 与水、乙醇混溶,不溶于乙醚 |
(1)KN3制备装置如图1所示,虚线框中最为合适的仪器是

(2)步骤②洗涤(CH3)2CHONO使用NaHCO3溶液的主要目的是
(3)写出由(CH3)2CHONO、N2H4·H2O和KOH反应生成KN3和(CH3)2CHOH的化学方程式
(4)下列说法正确的是_______。(填序号)
| A.步骤①为控制温度<0℃可用冰水浴 |
| B.步骤⑥加入无水乙醇和用冰盐浴的目的是促使KN3结晶析出并且得到大颗粒晶体 |
| C.步骤⑦可用乙醇、乙醚多次洗涤,目的之一是洗去吸附在晶体上的水分以减少产品损失和干燥时间 |
| D.步骤⑧操作X为:使用适量的乙醚溶解粗产品,然后过滤、洗涤、干燥 |
Ⅲ.纯度检测-“分光光度法”,其原理:Fe3+与N
 反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“N
反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“N 吸光度”曲线确定样品溶液中的c(N
吸光度”曲线确定样品溶液中的c(N )。
)。查阅文献可知:不同浓度的5.0mLKN3标准溶液,分别加入5.0mL(足量)FeCl3标准溶液,摇匀后测量吸光度,可绘制标准溶液的c(N
 )与吸光度的关系曲线图如图。
)与吸光度的关系曲线图如图。
纯度检测步骤如下:
①准确称量mgFeCl3·6H2O晶体,配制100mLFeCl3标准液(与文献浓度一致)。
②准确称量0.54gKN3样品,配制成100mL溶液,取5.0mL待测溶液加入VmL(足量)FeCl3标准液,摇匀后测得吸光度为0.6。
(5)配制FeCl3标准液:将mgFeCl3·6H2O晶体放入洁净的烧杯,
(6)步骤中②中取用FeCl3标准液V=
您最近一年使用:0次
2022-12-22更新
|
753次组卷
|
5卷引用:湖南省长沙市长郡中学2022-2023学年高三下学期第七次月考化学试题
湖南省长沙市长郡中学2022-2023学年高三下学期第七次月考化学试题浙江省金华第一中学等四校2022-2023学年高三上学期12月联考化学试题浙江省(杭州二中、温州中学、金华一中、绍兴一中)四校2023届高三上学期12月联考化学试题(已下线)化学-2023年高考押题预测卷02(浙江卷)(含考试版、全解全析、参考答案、答题卡)(已下线)热点22 定量分析型实验综合题
名校
解题方法
10 . 下列实验装置能达到实验目的的是
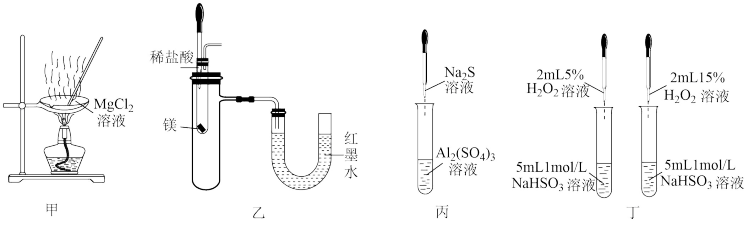
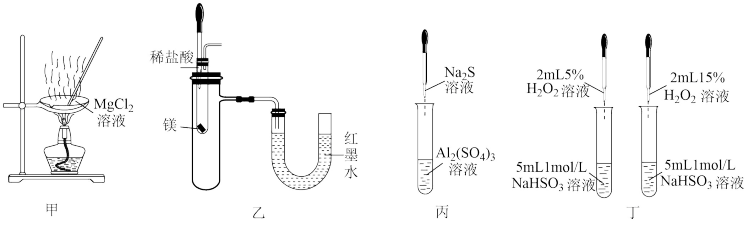
A.用装置甲蒸干 溶液获取 溶液获取 晶体 晶体 |
| B.用装置乙验证镁和稀盐酸反应的热效应 |
C.用装置丙制备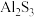 固体 固体 |
| D.用装置丁验证浓度对化学反应速率的影响 |
您最近一年使用:0次
2022-12-17更新
|
774次组卷
|
9卷引用:湖南省衡阳市第八中学2022-2023学年高二下学期第二次月考化学试题



