名校
解题方法
1 . 氢化镁(MgH2)可用作供氢剂。某兴趣小组以工业废渣(主要成分是MgO,含Al2O3、FeO、Fe2O3、MnO和SiO2等杂质)为原料制备氢化镁的流程如下:

已知:SOCl2遇水反应生成SO2和HCl。请回答下列问题:
(1)滤渣A的主要成分是_______ (填化学式),SOCl2的作用是_______ 。
(2)滤液A和次氯酸钠反应生成MnO2的离子方程式为_______ 。
(3)将一定量的工业废渣溶于一定体积4mol·L-1盐酸中,相同时间内镁元素的浸出率与温度的关系如图所示。其他条件相同,温度高于40℃时,镁元素的浸出率降低的主要原因可能是_______ 。

(4)①试剂X宜选择_______ (填字母)。
A.NaOH B. MgO C. Mg(OH)2 D. NH3·H2O
②电热水器中的镁棒可防止内胆(主要成分是铁)被腐蚀,这种保护金属的方法叫做_______ 。
③已知:常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-34,假设滤液B中含等物质的量浓度的Al3+与Fe3+,加入试剂X产生Al(OH)3沉淀的质量与X的质量关系如图所示。其中符合题意的是_______ (填字母)。

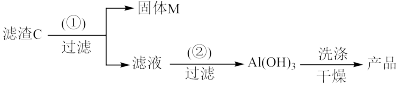
(5)为充分回收金属元素,设计以滤渣C为原料制备高纯度氢氧化铝的较优合成路线如下。请在括号里填入合适试剂:①_______ ;②_______ 。

已知:SOCl2遇水反应生成SO2和HCl。请回答下列问题:
(1)滤渣A的主要成分是
(2)滤液A和次氯酸钠反应生成MnO2的离子方程式为
(3)将一定量的工业废渣溶于一定体积4mol·L-1盐酸中,相同时间内镁元素的浸出率与温度的关系如图所示。其他条件相同,温度高于40℃时,镁元素的浸出率降低的主要原因可能是

(4)①试剂X宜选择
A.NaOH B. MgO C. Mg(OH)2 D. NH3·H2O
②电热水器中的镁棒可防止内胆(主要成分是铁)被腐蚀,这种保护金属的方法叫做
③已知:常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-34,假设滤液B中含等物质的量浓度的Al3+与Fe3+,加入试剂X产生Al(OH)3沉淀的质量与X的质量关系如图所示。其中符合题意的是

(5)为充分回收金属元素,设计以滤渣C为原料制备高纯度氢氧化铝的较优合成路线如下。请在括号里填入合适试剂:①

您最近一年使用:0次
2021-03-07更新
|
787次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2022-2023学年高三高考适应性测试(二)化学试题
解题方法
2 . 氯化亚砜(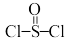 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
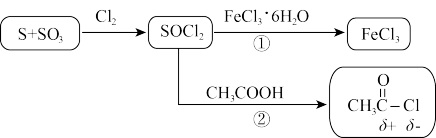
(1)用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2,原子利用率达100%。写出该反应方程式______ 。
(2)下列有关说法不正确 的是______ 。
(3)途径②除了CH3COCl外还产生两种酸性气体,写出该反应方程式______ 。
(4)SOCl2极易水解,试从共价键的极性角度分析其原因______ 。
(5)途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在______ 。
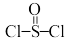 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
(1)用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2,原子利用率达100%。写出该反应方程式
(2)下列有关说法
| A.SO3是极性分子,容易与H2O发生反应 |
| B.途径①能制得无水FeCl3是因为SOCl2吸水性强且产物HCl能抑制Fe3+水解 |
C.FeCl3在溶液中分步水解,第一步反应为:Fe3++H2O Fe(OH)2++H+ Fe(OH)2++H+ |
| D.CH3COCl能与NH3反应生成乙酰胺 |
(4)SOCl2极易水解,试从共价键的极性角度分析其原因
(5)途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在
您最近一年使用:0次
名校
3 . H2O2 是一种绿色氧化还原试剂,在化学研究中应用广泛。
Ⅰ.某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。

(1)用以上装置测定H2O2分解反应速率,需要测定实验数据是_______ (要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%的H2O2溶液,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和0.2 mol/LFeCl3溶液。
①通过实验Ⅱ、Ⅲ探究的是_______ 对反应速率影响。
②实验Ⅱ、Ⅲ中溶液颜色变为红褐色的原因是_______ 。
③向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2 min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色,此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀,从平衡移动角度分析溶液红色褪去的原因_______ 。
Ⅱ.五氧化二氮是有机合成中常用的绿色硝化剂,常温下为白色固体,与水反应生成硝酸。某实验小组用滴定法测定N2O5粗品中N2O4的含量,具体操作为:取2.0 g粗品,加入20.00 mL0.1250mol/L酸性高锰酸钾溶液,充分反应后,用0.1000 mol/LH2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2 与HNO3不反应且不考虑其分解)
(3)产品中N2O4与KMnO4发生反应的离子方程式为_______ 。
(4)判断滴定终点的方法是_______ 。
(5)产品中N2O4的质量分数为_______ 。
Ⅰ.某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。

(1)用以上装置测定H2O2分解反应速率,需要测定实验数据是
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%的H2O2溶液,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和0.2 mol/LFeCl3溶液。
| 序号 | H2O2/mL | 蒸馏水/mL | FeCl3溶液/mL | 现象 |
| Ⅰ | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红褐色,并有较多气泡产生;2 min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变红褐色,开始5 s后产生较少的气泡 |
②实验Ⅱ、Ⅲ中溶液颜色变为红褐色的原因是
③向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2 min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色,此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀,从平衡移动角度分析溶液红色褪去的原因
Ⅱ.五氧化二氮是有机合成中常用的绿色硝化剂,常温下为白色固体,与水反应生成硝酸。某实验小组用滴定法测定N2O5粗品中N2O4的含量,具体操作为:取2.0 g粗品,加入20.00 mL0.1250mol/L酸性高锰酸钾溶液,充分反应后,用0.1000 mol/LH2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2 与HNO3不反应且不考虑其分解)
(3)产品中N2O4与KMnO4发生反应的离子方程式为
(4)判断滴定终点的方法是
(5)产品中N2O4的质量分数为
您最近一年使用:0次
4 . 碳酸锰可用作脱硫的催化剂,是合成二氧化锰和制造其他锰盐的原料。工业上从锰泥(主要含 和少量
和少量 、
、 、
、 等)中回收
等)中回收 的流程如图所示:
的流程如图所示:

回答下列问题:
(1)滤渣1中的主要成分是___________ 。
(2) 能将
能将 还原为.
还原为. .,写出该反应的离子方程式:
.,写出该反应的离子方程式:___________ 。
为检验 是否被氧化,可往滤液1中加入
是否被氧化,可往滤液1中加入___________ 溶液(填化学式)。
(3)写出加入氨水和过量 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
(4)处理锰泥时, 、
、 混合溶液中
混合溶液中 比值不宜过大,请从节约药品的角度分析,原因是
比值不宜过大,请从节约药品的角度分析,原因是 ___________ 。
 和少量
和少量 、
、 、
、 等)中回收
等)中回收 的流程如图所示:
的流程如图所示:
回答下列问题:
(1)滤渣1中的主要成分是
(2)
 能将
能将 还原为.
还原为. .,写出该反应的离子方程式:
.,写出该反应的离子方程式:为检验
 是否被氧化,可往滤液1中加入
是否被氧化,可往滤液1中加入(3)写出加入氨水和过量
 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:(4)处理锰泥时,
 、
、 混合溶液中
混合溶液中 比值不宜过大,请从节约药品的角度分析,原因是
比值不宜过大,请从节约药品的角度分析,原因是
您最近一年使用:0次
名校
5 . 亚硫酰氯(SOC12)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79°C,140°C 以上时易分解。遇水剧烈反应生成SO2和HCl两种气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。
(1)实验室合成SOC12的原理之一为SO2+Cl2+SC12 2SOC12,部分装置(夹持、加热装置略去)如图所示。
2SOC12,部分装置(夹持、加热装置略去)如图所示。
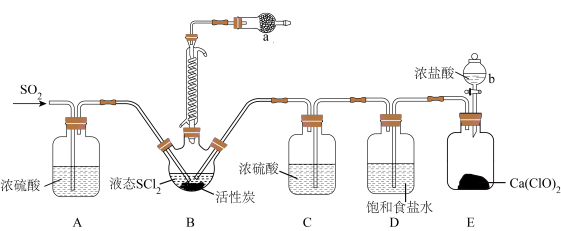
①仪器b的名称为___________ 。
②装置B中蛇形冷凝管的作用是:___________ 。
③装置A.C除干燥气体外,另一作用是___________ ;装置D的作用为___________ 。
④写出装置E中发生反应的化学方程式:___________ 。
⑤仪器a的作用是___________ 。
(2)甲同学设计实验利用SOC12和A1Cl3·6H2O混合加热制取无水A1Cl3.
①用SOC12和A1Cl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为___________ 。
②实验室常用过量NaOH溶液吸收SOC12,写出反应的离子方程式:___________ 。
(1)实验室合成SOC12的原理之一为SO2+Cl2+SC12
 2SOC12,部分装置(夹持、加热装置略去)如图所示。
2SOC12,部分装置(夹持、加热装置略去)如图所示。
①仪器b的名称为
②装置B中蛇形冷凝管的作用是:
③装置A.C除干燥气体外,另一作用是
④写出装置E中发生反应的化学方程式:
⑤仪器a的作用是
(2)甲同学设计实验利用SOC12和A1Cl3·6H2O混合加热制取无水A1Cl3.
①用SOC12和A1Cl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为
②实验室常用过量NaOH溶液吸收SOC12,写出反应的离子方程式:
您最近一年使用:0次
6 . 科学家成功研制了太空用高强度延展合金——FeCoNiCr和C合金。某小组以镍废料(主要含Ni,还含少量Cu、Fe、Al等金属)为原料制备合成太空合金所用的镍,流程如图所示:

①已知几种金属氢氧化物沉淀的pH如表所示:
②镍的金属性介于镁和氢之间。
回答下列问题:
(1)“酸浸”时不用浓硫酸替代稀硫酸,其主要原因是___________ (答一条)。
(2)“滤渣2”的主要成分是NiO、___________ (填化学式)。
(3)如果省去 ,对该流程的影响是
,对该流程的影响是___________ 。
(4)下列试剂可以替代NiO的是___________(填标号)。
(5)“电解”时以石墨为电极,阳极的电极反应式为___________ 。
(6)雷尼镍(镍铝合金)是储氢材料,常作有机氢化反应的高效催化剂,制备雷尼镍的工艺流程如下:

①进行“操作X”时所用的玻璃仪器有___________ 。
②向“操作X”所得的“溶液”中缓慢通入 气体,产生沉淀的质量与
气体,产生沉淀的质量与 气体体积之间的关系如图所示,OA段不产生沉淀的原因是
气体体积之间的关系如图所示,OA段不产生沉淀的原因是___________ ;AB段的离子方程式为___________ 。


①已知几种金属氢氧化物沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.5 |
回答下列问题:
(1)“酸浸”时不用浓硫酸替代稀硫酸,其主要原因是
(2)“滤渣2”的主要成分是NiO、
(3)如果省去
 ,对该流程的影响是
,对该流程的影响是(4)下列试剂可以替代NiO的是___________(填标号)。
A. | B. | C.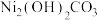 | D.CuO |
(6)雷尼镍(镍铝合金)是储氢材料,常作有机氢化反应的高效催化剂,制备雷尼镍的工艺流程如下:

①进行“操作X”时所用的玻璃仪器有
②向“操作X”所得的“溶液”中缓慢通入
 气体,产生沉淀的质量与
气体,产生沉淀的质量与 气体体积之间的关系如图所示,OA段不产生沉淀的原因是
气体体积之间的关系如图所示,OA段不产生沉淀的原因是
您最近一年使用:0次
名校
7 . 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105℃,沸点79℃,140℃以上时易分解。遇水剧烈反应生成SO2和另一种酸性气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。
实验室合成SOCl2的原理之一为SO2+Cl2+SCl2 2SOCl2,部分装置(夹持、加热装置略去)如图所示。
2SOCl2,部分装置(夹持、加热装置略去)如图所示。
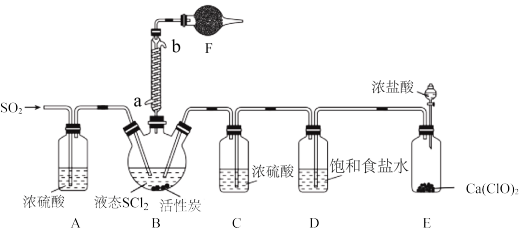
(1)①仪器F的名称为_______ ,所盛的试剂是______ ;
②装置A、C除干燥气体外,另一作用可能是__________________________________ ;
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为_________
③E中反应的化学方程式:_______________________________ 。
(2)甲同学认为SOCl2和FeCl3∙6H2O混合加热可制得无水FeCl3,但乙同学认为该实验可能发生副反应使产品不纯。乙同学设计如下实验判断副反应的可能性:取少量FeCl3∙6H2O于试管中,加入足量SOCl2,充分反应后向试管中加水溶解,用四支试管各取溶解后的溶液少许,分别进行下列实验,通过现象能验证发生副反应的是_______ (填选项字母)。
a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水
(3)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液,检验该溶液中存在Cl-的需要用到的试剂是_______________________
实验室合成SOCl2的原理之一为SO2+Cl2+SCl2
 2SOCl2,部分装置(夹持、加热装置略去)如图所示。
2SOCl2,部分装置(夹持、加热装置略去)如图所示。
(1)①仪器F的名称为
②装置A、C除干燥气体外,另一作用可能是
如果没有A、C,二氧化硫与氯气在装置B中会有副反应发生,该反应的离子方程式为
③E中反应的化学方程式:
(2)甲同学认为SOCl2和FeCl3∙6H2O混合加热可制得无水FeCl3,但乙同学认为该实验可能发生副反应使产品不纯。乙同学设计如下实验判断副反应的可能性:取少量FeCl3∙6H2O于试管中,加入足量SOCl2,充分反应后向试管中加水溶解,用四支试管各取溶解后的溶液少许,分别进行下列实验,通过现象能验证发生副反应的是
a.滴加BaCl2溶液 b.滴加K3[Fe(CN)6]溶液
c.滴加酸性KMnO4溶液 d.滴加溴水
(3)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液,检验该溶液中存在Cl-的需要用到的试剂是
您最近一年使用:0次
2022-05-12更新
|
1056次组卷
|
4卷引用:湖南省攸县第一中学2022-2023学年高三第五次月考化学试题
湖南省攸县第一中学2022-2023学年高三第五次月考化学试题(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究江西省鹰潭市2022届高三第二次模拟考试理科综合化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题
解题方法
8 . 常温下 是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有
是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有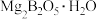 、
、 ,次要成分有
,次要成分有 、
、 、
、 、
、 )和萤石(主要成分为
)和萤石(主要成分为 ,含微量二氧化硅、硫单质)为原料制备
,含微量二氧化硅、硫单质)为原料制备 的流程如图所示:
的流程如图所示:

已知:① 溶液在“热溶浸”中,只能溶解
溶液在“热溶浸”中,只能溶解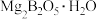 ;
;
②室温下,溶液 时,
时, 的溶解度为
的溶解度为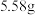 ;
;
③相关金属离子形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:
回答下列问题:
(1)产生的气体A是______ ;“热溶浸”时,下列措施能提高硼元素浸出率的有______ (填序号)。
a.粉碎矿石 b.适当升高“热溶浸”温度
c.适当缩短“热溶浸”时间 d.加快搅拌速度
(2)已知硼酸在水中的电离方程式为 。室温下,调节过滤1所得滤液的
。室温下,调节过滤1所得滤液的 值为4,析出硼酸固体,则滤液2中
值为4,析出硼酸固体,则滤液2中
_________  。
。
(3)补充完整反应釜中发生主要反应的化学方程式:①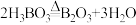 ;②
;②___________ ;过量浓硫酸的作用是___________ (答出2点)。
(4)根据下表,选择反应釜中的最佳反应条件:温度为________ ,硫酸质量分数为________ 。
不同反应条件对 产率的影响
产率的影响
(5)利用离子色谱法可以检测过滤3所得滤液中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果,出现检测峰1的原因可能是___________ 。

(6)滤渣1通过下图所示操作可逐一分离硅、铝、铁三种元素,试剂①是___________ (填化学式),调节 的范围是
的范围是___________ 。

 是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有
是一种无色气体,能溶于浓硫酸、易水解,是有机合成和石油化工广泛应用的一种重要催化剂。工业上以铁硼矿(主要成分有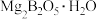 、
、 ,次要成分有
,次要成分有 、
、 、
、 、
、 )和萤石(主要成分为
)和萤石(主要成分为 ,含微量二氧化硅、硫单质)为原料制备
,含微量二氧化硅、硫单质)为原料制备 的流程如图所示:
的流程如图所示:
已知:①
 溶液在“热溶浸”中,只能溶解
溶液在“热溶浸”中,只能溶解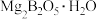 ;
;②室温下,溶液
 时,
时, 的溶解度为
的溶解度为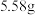 ;
;③相关金属离子形成氢氧化物沉淀的
 范围如下表所示:
范围如下表所示:| 金属离子 |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 3.2 |
沉淀完全的 | 3.2 | 8.3 | 5.0 |
(1)产生的气体A是
a.粉碎矿石 b.适当升高“热溶浸”温度
c.适当缩短“热溶浸”时间 d.加快搅拌速度
(2)已知硼酸在水中的电离方程式为
 。室温下,调节过滤1所得滤液的
。室温下,调节过滤1所得滤液的 值为4,析出硼酸固体,则滤液2中
值为4,析出硼酸固体,则滤液2中
 。
。(3)补充完整反应釜中发生主要反应的化学方程式:①
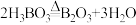 ;②
;②(4)根据下表,选择反应釜中的最佳反应条件:温度为
不同反应条件对
 产率的影响
产率的影响| 反应温度/℃ |  产率/% 产率/% | |
硫酸质量分数 | 硫酸质量分数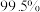 | |
| 60 | 9.5 | 54 |
| 70 | 11 | 62.5 |
| 80 | 37.4 | 78.8 |
| 90 | 47.7 | 82 |
| 100 | 47.1 | 81.4 |
| 110 | 46.5 | 80.5 |
| 120 | 46 | 79 |
(5)利用离子色谱法可以检测过滤3所得滤液中硫元素的含量,将样品通过检测液,进行色谱分析,得到如图所示结果,出现检测峰1的原因可能是

(6)滤渣1通过下图所示操作可逐一分离硅、铝、铁三种元素,试剂①是
 的范围是
的范围是
您最近一年使用:0次
9 . 研究发现,Cu/Al(OH)3催化剂在工业上有着巨大作用。现以硫酸烧渣(主要成分为Fe2O3、Al2O3、CuO和SiO2等)为原料制备Cu/ Al(OH)3催化剂,流程如图所示:
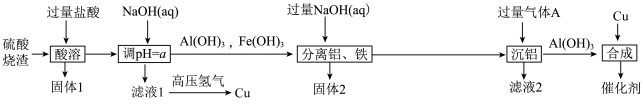
已知常温下,①几种金属离子沉淀的pH如表所示:
②电离常数 H2CO3 Ka1=4.4×10-7 Ka2=4.7×10-11
③A为无色无味气体
回答下列问题:
(1)举一个“固体1”的用途___________ ,“固体2”灼烧产物是___________ (填名称),“分离铝、铁”的操作名称为___________ 。
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度不能太高,其原因是___________ 。
(3)a的范围为___________ , “滤液1”中通入高压氢制备铜的离子方程式为___________ 。
(4)“沉铝”的离子方程式为___________ ,“滤液2”的pH___________ 7(25℃) (填“>”“<”或“=”),判断依据是___________ 。
(5)合成催化剂 ,测定Cu与Al(OH)3的比例:将制得的“催化剂Cu/Al(OH)3”在空气中充分灼烧为CuO和Al2O3,固体质量不改变,则催化剂中n(Cu) : n[Al(OH)3]=___________ 。

已知常温下,①几种金属离子沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Cu2+ |
| 开始沉淀pH | 1.9 | 3.4 | 7.4 |
| 完全沉淀pH | 3.7 | 4.7 | 9.6 |
③A为无色无味气体
回答下列问题:
(1)举一个“固体1”的用途
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度不能太高,其原因是
(3)a的范围为
(4)“沉铝”的离子方程式为
(5)合成催化剂 ,测定Cu与Al(OH)3的比例:将制得的“催化剂Cu/Al(OH)3”在空气中充分灼烧为CuO和Al2O3,固体质量不改变,则催化剂中n(Cu) : n[Al(OH)3]=
您最近一年使用:0次
10 . 回答下列问题:
(1)蒸发浓缩MgCl2溶液时,加入SOCl2的目的是______ 。
(2)醋酸亚铬[(CH3COO)2Cr•2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图1所示。
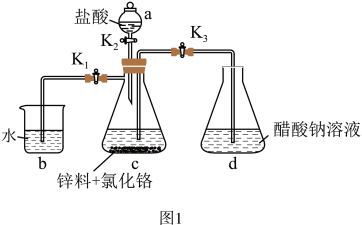
实验中所用蒸馏水均需经者沸后迅速冷却,目的是______ 。
(3)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4•H2O(水合肼)和无水Na2SO3,其主要实验流程如图2:
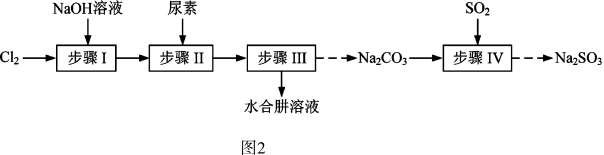
已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4•H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
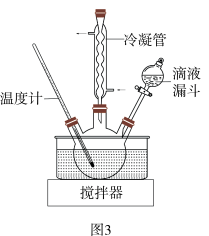
步骤II合成N2H4•H2O的装置如图3所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是______ ;使用冷疑管的目的是______ 。
(1)蒸发浓缩MgCl2溶液时,加入SOCl2的目的是
(2)醋酸亚铬[(CH3COO)2Cr•2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图1所示。

实验中所用蒸馏水均需经者沸后迅速冷却,目的是
(3)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4•H2O(水合肼)和无水Na2SO3,其主要实验流程如图2:

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4•H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤II合成N2H4•H2O的装置如图3所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是

您最近一年使用:0次



