名校
解题方法
1 . 氢化镁(MgH2)可用作供氢剂。某兴趣小组以工业废渣(主要成分是MgO,含Al2O3、FeO、Fe2O3、MnO和SiO2等杂质)为原料制备氢化镁的流程如下:

已知:SOCl2遇水反应生成SO2和HCl。请回答下列问题:
(1)滤渣A的主要成分是_______ (填化学式),SOCl2的作用是_______ 。
(2)滤液A和次氯酸钠反应生成MnO2的离子方程式为_______ 。
(3)将一定量的工业废渣溶于一定体积4mol·L-1盐酸中,相同时间内镁元素的浸出率与温度的关系如图所示。其他条件相同,温度高于40℃时,镁元素的浸出率降低的主要原因可能是_______ 。

(4)①试剂X宜选择_______ (填字母)。
A.NaOH B. MgO C. Mg(OH)2 D. NH3·H2O
②电热水器中的镁棒可防止内胆(主要成分是铁)被腐蚀,这种保护金属的方法叫做_______ 。
③已知:常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-34,假设滤液B中含等物质的量浓度的Al3+与Fe3+,加入试剂X产生Al(OH)3沉淀的质量与X的质量关系如图所示。其中符合题意的是_______ (填字母)。

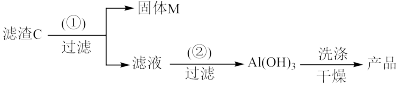
(5)为充分回收金属元素,设计以滤渣C为原料制备高纯度氢氧化铝的较优合成路线如下。请在括号里填入合适试剂:①_______ ;②_______ 。

已知:SOCl2遇水反应生成SO2和HCl。请回答下列问题:
(1)滤渣A的主要成分是
(2)滤液A和次氯酸钠反应生成MnO2的离子方程式为
(3)将一定量的工业废渣溶于一定体积4mol·L-1盐酸中,相同时间内镁元素的浸出率与温度的关系如图所示。其他条件相同,温度高于40℃时,镁元素的浸出率降低的主要原因可能是

(4)①试剂X宜选择
A.NaOH B. MgO C. Mg(OH)2 D. NH3·H2O
②电热水器中的镁棒可防止内胆(主要成分是铁)被腐蚀,这种保护金属的方法叫做
③已知:常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-34,假设滤液B中含等物质的量浓度的Al3+与Fe3+,加入试剂X产生Al(OH)3沉淀的质量与X的质量关系如图所示。其中符合题意的是

(5)为充分回收金属元素,设计以滤渣C为原料制备高纯度氢氧化铝的较优合成路线如下。请在括号里填入合适试剂:①

您最近一年使用:0次
2021-03-07更新
|
784次组卷
|
2卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2021届高三第一次联合模拟考试(3月)理综化学试题
名校
解题方法
2 . 某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
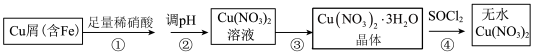
已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质______ (填化学式),调 pH 后需进行的操作是_____ 。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至______ 。
(3)第④步中发生反应的化学方程式是______ 。
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由_______ 。
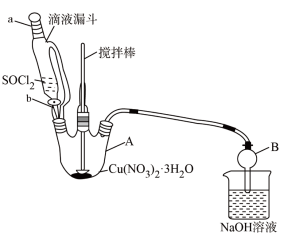
装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞_____ (填“a”“b”或“a 和 b”)。
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:_______ 。
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:
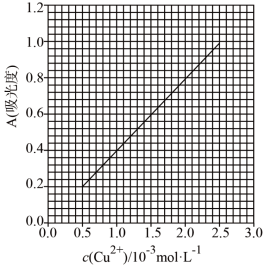
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_______ (以质量分数表示)。

已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至
(3)第④步中发生反应的化学方程式是
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由

装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是
您最近一年使用:0次
3 . 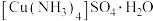 常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
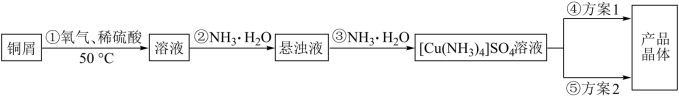
已知:①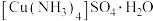 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
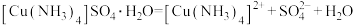 、
、 。
。
② 和
和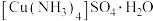 在水中均可溶,在乙醇中均难溶。若向
在水中均可溶,在乙醇中均难溶。若向 溶液中加入乙醇,会析出
溶液中加入乙醇,会析出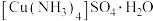 晶体。
晶体。
请回答下列问题:
(1)实验室用下图装置制备合成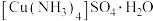 所需的
所需的 溶液。
溶液。
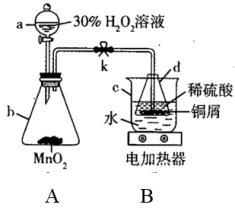
①仪器a的名称是____ ;仪器d中发生反应的离子方程式是___ 。
②说明检验装置A气密性的方法:____ 。
③装置B的加热方法为水浴加热,其优点是___ 。
(2)方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有__ (填化学式)杂质,其原因是__ (从平衡移动的角度回答)。
(3)方案2的实验步骤为:向 溶液中加入适量
溶液中加入适量____ (填试剂名称),过滤、洗涤、干燥。
(4)方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:
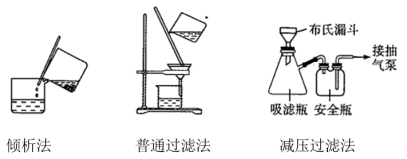
减压过滤法相对于普通过滤法的优点为____ (填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是____ 。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
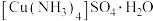 常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
已知:①
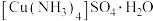 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
为绛蓝色晶体,在溶液中存在以下电离(解离)过程: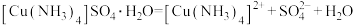 、
、 。
。②
 和
和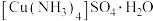 在水中均可溶,在乙醇中均难溶。若向
在水中均可溶,在乙醇中均难溶。若向 溶液中加入乙醇,会析出
溶液中加入乙醇,会析出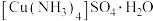 晶体。
晶体。请回答下列问题:
(1)实验室用下图装置制备合成
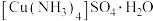 所需的
所需的 溶液。
溶液。
①仪器a的名称是
②说明检验装置A气密性的方法:
③装置B的加热方法为水浴加热,其优点是
(2)方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有
(3)方案2的实验步骤为:向
 溶液中加入适量
溶液中加入适量(4)方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:

减压过滤法相对于普通过滤法的优点为
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
您最近一年使用:0次
2021-04-25更新
|
615次组卷
|
4卷引用:河北省邯郸市2021届高三第二次模拟考试化学试题
河北省邯郸市2021届高三第二次模拟考试化学试题(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)2022届重庆市缙云教育联盟高三第〇次诊断性检测化学试题
解题方法
4 . 氯化亚砜(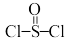 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
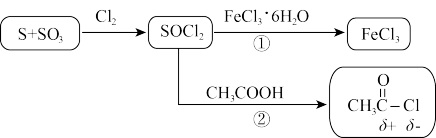
(1)用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2,原子利用率达100%。写出该反应方程式______ 。
(2)下列有关说法不正确 的是______ 。
(3)途径②除了CH3COCl外还产生两种酸性气体,写出该反应方程式______ 。
(4)SOCl2极易水解,试从共价键的极性角度分析其原因______ 。
(5)途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在______ 。
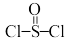 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
(1)用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2,原子利用率达100%。写出该反应方程式
(2)下列有关说法
| A.SO3是极性分子,容易与H2O发生反应 |
| B.途径①能制得无水FeCl3是因为SOCl2吸水性强且产物HCl能抑制Fe3+水解 |
C.FeCl3在溶液中分步水解,第一步反应为:Fe3++H2O Fe(OH)2++H+ Fe(OH)2++H+ |
| D.CH3COCl能与NH3反应生成乙酰胺 |
(4)SOCl2极易水解,试从共价键的极性角度分析其原因
(5)途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在
您最近一年使用:0次
解题方法
5 . 氯化铜广泛地用作有机合成催化剂。实验室模拟工业以粗铜粉(含杂质Fe)为原料,制备氯化铜。某小组设计的实验方案如下:
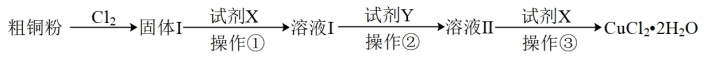
已知:
i.粗铜粉与气体完全反应。
ii.部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为 计算)。
计算)。
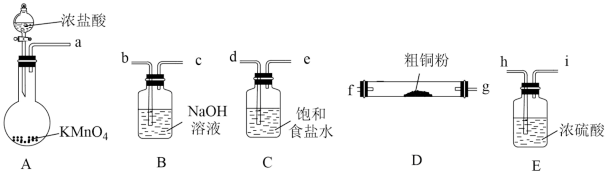
(1)现用如图所示的实验仪器和药品制备纯净、干燥的 并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→
并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→___________ (填小写字母)。。
(2)上述方案中,试剂X的名称是___________ ;试剂Y的作用是___________ (用离子方程式表示);操作③是___________ 。
(3)在溶液Ⅱ转化为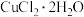 的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知:
的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知: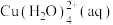 (蓝色)
(蓝色) (绿色)
(绿色)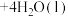 。
。
设计简单实验,证明溶液中有上述转化关系___________ 。
(4)为测定产品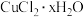 中结晶水的数目x,可采取如下实验步骤:
中结晶水的数目x,可采取如下实验步骤:
a.用托盘天平称取一定质量氯化铜晶体。
b.在坩埚中充分灼烧。
c.在___________ (填仪器名称)中冷却。
d.称量所得黑色固体质量。
e.重复b~d操作直至___________ 。
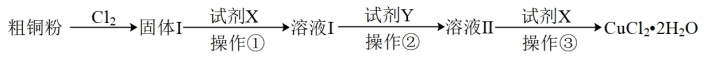
已知:
i.粗铜粉与气体完全反应。
ii.部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为
 计算)。
计算)。| 离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.1 | 3.2 |
 | 4.4 | 6.4 |
 并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→
并与粗铜粉反应(夹持及加热装置已省略)。按气流从左到右的方向连接各仪器接口,正确的顺序是a→
(2)上述方案中,试剂X的名称是
(3)在溶液Ⅱ转化为
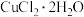 的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知:
的操作过程中,发现溶液颜色由蓝色变为绿色。同学欲探究其原因,查文献知: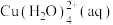 (蓝色)
(蓝色) (绿色)
(绿色)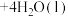 。
。设计简单实验,证明溶液中有上述转化关系
(4)为测定产品
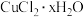 中结晶水的数目x,可采取如下实验步骤:
中结晶水的数目x,可采取如下实验步骤:a.用托盘天平称取一定质量氯化铜晶体。
b.在坩埚中充分灼烧。
c.在
d.称量所得黑色固体质量。
e.重复b~d操作直至
您最近一年使用:0次
6 . 次氯酸锂稳定性远高于次氯酸钠,也可用于杀菌消毒。制备次氯酸锂方法较多,常用的一种合成路线如图:

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是________ ;②浓盐酸逐滴滴加而不是一次性加入的原因是__________ 。
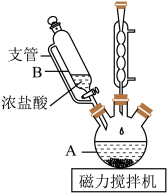
(2)请写出在装置A中发生反应的化学方程式______________ 。
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因___________ 。
(4)该实验中次氯酸锂的产率为_________ 。

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;
2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),①B装置中支管的作用是

(2)请写出在装置A中发生反应的化学方程式
(3)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因
(4)该实验中次氯酸锂的产率为
您最近一年使用:0次
2019-09-09更新
|
107次组卷
|
2卷引用:四川省射洪县射洪中学2020届高三补习班上学期入学考试化学试题
名校
7 . 二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为________ 。写出SOCl2吸收水蒸气的化学方程式:___________ 。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
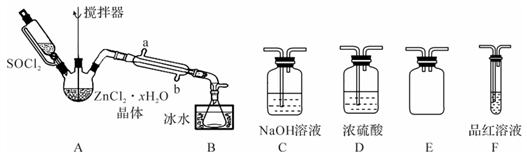
①装置的连接顺序为A→B→______→______→______→______。______________
②搅拌的作用是______ ,冷凝管的作用是_______________________________ 。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg。若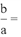
_____ (保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热即可得到无水ZnCl2,但老师说此方法不可。请用化学方程式解释原因:______________________________________ 。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。请你设计并简述实验方案判断丁同学的观点:_____________ 。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):

①装置的连接顺序为A→B→______→______→______→______。
②搅拌的作用是
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg。若
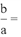
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热即可得到无水ZnCl2,但老师说此方法不可。请用化学方程式解释原因:
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。请你设计并简述实验方案判断丁同学的观点:
您最近一年使用:0次
2017-11-23更新
|
351次组卷
|
2卷引用:湖北省部分重点高中协作体2018届高三上学期期中联考化学试题
名校
解题方法
8 . 二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点—105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________ 。写出SOCl2吸收水蒸气的化学方程式:_______________________________ 。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。
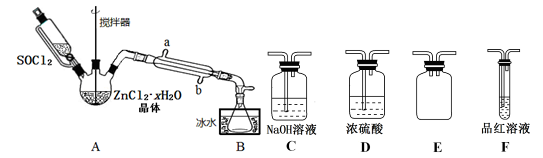
①装置的连接顺序为A→B→____ →___ →___ →____ 。
②冷凝管的进水口是_______________ 。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若 =
=___ (保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________ 。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________ 或______________ (填离子符号)是否存在证明该过程是否发生了氧化还原反应。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→
②冷凝管的进水口是
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若
 =
=④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明
您最近一年使用:0次
名校
9 . 以含镓废料[主要成分为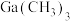 ]为原料制备半导体材料
]为原料制备半导体材料 的工艺如图所示。已知:
的工艺如图所示。已知: 和
和 的性质相似。下列叙述错误的是
的性质相似。下列叙述错误的是
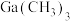 ]为原料制备半导体材料
]为原料制备半导体材料 的工艺如图所示。已知:
的工艺如图所示。已知: 和
和 的性质相似。下列叙述错误的是
的性质相似。下列叙述错误的是 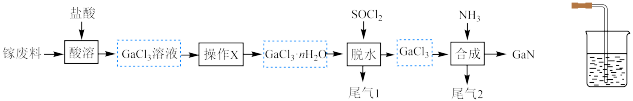
A.操作 不宜温度过高 不宜温度过高 |
B.用 固体可替代“脱水”中的 固体可替代“脱水”中的 |
C.用酸性 溶液可检验“脱水”产生的气体含 溶液可检验“脱水”产生的气体含 |
| D.不能用如图装置吸收“合成”中尾气 |
您最近一年使用:0次
2024-04-01更新
|
186次组卷
|
2卷引用:吉林省白山市2023-2024学年高三第二次模拟考试化学试题
名校
解题方法
10 . 某科研小组制备了新型锂离子电池电极材料-ZnLix/Li3N。科研小组以废旧锌锰电池的锌皮为原料合成该电极材料,简易流程如下:

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
回答下列问题:
(1)提高“酸浸”速率的措施有_____ (答一条即可),“调pH”的范围为_____ 。
(2)“沉锌”的离子方程式为_____ 。
(3)系列操作包括的操作步骤有_____ 、过滤、洗涤、干燥
(4)SOCl2的作用是_____ (用化学方程式表示)。
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
如果氧化剂X选择硝酸,其后果是_____ 和会产生大气污染物。从下列物质中选择氧化剂X,杂质除去率最高的是_____ (填标号)。
A.NaClO B.Cl2 C.O2 D.O3
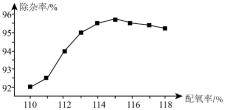
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:_____ 。

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 2.2 | 7.5 | 8.0 | 6.5 |
| 完全沉淀的pH | 3.5 | 9.5 | 10.8 | 8.5 |
(1)提高“酸浸”速率的措施有
(2)“沉锌”的离子方程式为
(3)系列操作包括的操作步骤有
(4)SOCl2的作用是
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
| 物质 | HClO/Cl- | Cl2/Cl- | O2/H2O | O3/O2 | HNO3/NO | Fe3+/Fe2+ | MnO2/Mn2+ |
| φ0 | 1.482 | 1.358 | 1.229 | 2.076 | 0.983 | 0.771 | 1.224 |
A.NaClO B.Cl2 C.O2 D.O3
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:

您最近一年使用:0次



