名校
1 . 25℃时实验室模拟侯氏制碱碳酸化制 的过程,将
的过程,将 通入饱和氨盐水(溶质为
通入饱和氨盐水(溶质为 、NaCl)中,实验现象及数据如图1,含碳粒子在水溶液中的物质的量分数(δ)与pH的关系如图2。
、NaCl)中,实验现象及数据如图1,含碳粒子在水溶液中的物质的量分数(δ)与pH的关系如图2。
 的过程,将
的过程,将 通入饱和氨盐水(溶质为
通入饱和氨盐水(溶质为 、NaCl)中,实验现象及数据如图1,含碳粒子在水溶液中的物质的量分数(δ)与pH的关系如图2。
、NaCl)中,实验现象及数据如图1,含碳粒子在水溶液中的物质的量分数(δ)与pH的关系如图2。
A.0 min时,水电离出的 mol/L mol/L |
B.60 min时,溶液中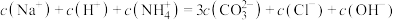 ) ) |
C.60 min~100 min,溶液中, 与 与 的乘积在减小 的乘积在减小 |
D.100 min时,向上层清液中滴加 溶液,无沉淀生成 溶液,无沉淀生成 |
您最近一年使用:0次
2 . 已知: 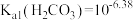 、
、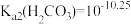 。室温下,通过下列实验探究NaHCO3溶液的性质。
。室温下,通过下列实验探究NaHCO3溶液的性质。
下列有关说法正确的是
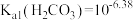 、
、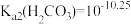 。室温下,通过下列实验探究NaHCO3溶液的性质。
。室温下,通过下列实验探究NaHCO3溶液的性质。| 实验 | 实验操作和现象 |
| 1 | 测量0.1mol·L-1的NaHCO3溶液的pH为7.8 |
| 2 | 向0.1mol·L-1的NaHCO3溶液中持续通入CO2,溶液的pH减小 |
| 3 | 向0.1mol·L-1的NaHCO3溶液中加入少量 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 4 | 向0.5mol·L-1的NaHCO3溶液中滴加少量0.5mol·L-1的CaCl2溶液,产生白色沉淀和无色气体 |
A.实验1溶液中存在: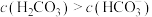 |
B.实验2中随CO2的不断通入,溶液中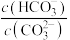 的值逐渐变小 的值逐渐变小 |
C.实验3反应的离子方程式为 |
D.实验4所得溶液中存在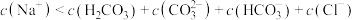 |
您最近一年使用:0次
名校
解题方法
3 . 以某石膏矿(主要成分是 ,含少量的
,含少量的 、
、 等杂质)为原料制备轻质
等杂质)为原料制备轻质 、
、 和
和 产品的工艺流程如下:
产品的工艺流程如下: 溶出。
溶出。
①“溶浸”时发生反应的化学方程式为______ 。
②“溶浸”时通常还加入一定量的氨水,加入氨水的作用是______ 。
③“溶浸”时, 的浸出率与
的浸出率与 的关系如图所示:
的关系如图所示:
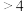 时,
时, 浸出率随着
浸出率随着 的增大而减小的原因是
的增大而减小的原因是______ 。
(2)将滤渣高温煅烧,冷却后用 溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。
溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。
①滤渣中含有的物质是______ 。
②在敞口容器中,用 溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中 增大的原因是
增大的原因是______ 。
(3)“盐化”过程中加入适量盐酸的目的是______ 。
(4) 、
、 的溶解度如图所示,“结晶”过程中先分离出
的溶解度如图所示,“结晶”过程中先分离出 晶体的方法是
晶体的方法是______ 。 的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知:
的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知: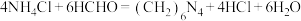 ,计算样品中
,计算样品中 的质量分数。
的质量分数。______ (写出计算过程)
 ,含少量的
,含少量的 、
、 等杂质)为原料制备轻质
等杂质)为原料制备轻质 、
、 和
和 产品的工艺流程如下:
产品的工艺流程如下: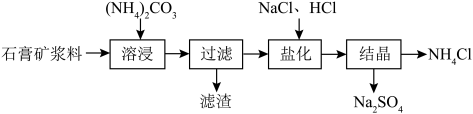
 溶出。
溶出。①“溶浸”时发生反应的化学方程式为
②“溶浸”时通常还加入一定量的氨水,加入氨水的作用是
③“溶浸”时,
 的浸出率与
的浸出率与 的关系如图所示:
的关系如图所示: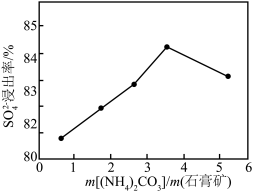

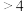 时,
时, 浸出率随着
浸出率随着 的增大而减小的原因是
的增大而减小的原因是(2)将滤渣高温煅烧,冷却后用
 溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。
溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。①滤渣中含有的物质是
②在敞口容器中,用
 溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中 增大的原因是
增大的原因是(3)“盐化”过程中加入适量盐酸的目的是
(4)
 、
、 的溶解度如图所示,“结晶”过程中先分离出
的溶解度如图所示,“结晶”过程中先分离出 晶体的方法是
晶体的方法是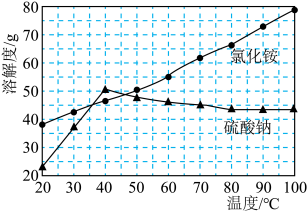
 的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知:
的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知: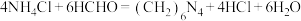 ,计算样品中
,计算样品中 的质量分数。
的质量分数。
您最近一年使用:0次
名校
4 . 根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 将 溶液与 溶液与 溶液混合,生成白色 溶液混合,生成白色 沉淀 沉淀 | 结合质子能力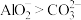 |
B | 将溴乙烷和氢氧化钠的乙醇溶液共热后产生的气体通入酸性 溶液,溶液褪色 溶液,溶液褪色 | 溴乙烷发生消去反应 |
C | 向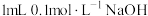 溶液中加入 溶液中加入 溶液,振荡后滴加 溶液,振荡后滴加 葡萄糖溶液,加热,无砖红色沉淀 葡萄糖溶液,加热,无砖红色沉淀 | 葡萄糖中不含有醛基 |
D | 向淀粉溶液中加适量20%的 溶液,加热,冷却后加 溶液,加热,冷却后加 溶液至中性,再滴加碘水,溶液变蓝 溶液至中性,再滴加碘水,溶液变蓝 | 淀粉未水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 室温下,通过下列实验探究某些碳酸盐溶液及碳酸氢盐溶液的性质。
已知: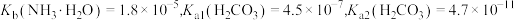 。
。
下列有关说法正确的是
已知:
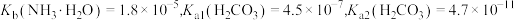 。
。| 实验 | 实验操作和现象 |
| 1 | 测量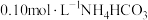 溶液的 溶液的 ,测得 ,测得 为 为 |
| 2 | 测量某浓度的 溶液的 溶液的 ,测得 ,测得 约为9.4 约为9.4 |
| 3 | 将两种浓度均为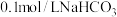 和 和 溶液等体积混合,测量其 溶液等体积混合,测量其 |
A.实验1溶液中: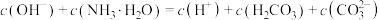 |
B.实验1测得的 值 值 |
C.实验2溶液中: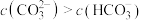 |
D.实验3所得溶液中: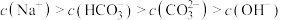 |
您最近一年使用:0次
6 . 室温下,下列探究方案能达到探究目的的是
| 序号 | 探究方案 | 探究目的 |
| ① | 用不同浓度、等体积的 溶液分别与相同浓度相同体积的 溶液分别与相同浓度相同体积的 溶液反应,观察现象 溶液反应,观察现象 | 探究浓度对反应速率的影响 |
| ② | 用pH计测定同浓度NaClO和NaF溶液的pH,比较溶液pH大小 | 比较HClO与HF的酸性强弱 |
| ③ | 向 和 和 混合溶液中滴加少量 混合溶液中滴加少量 溶液,观察沉淀颜色变化 溶液,观察沉淀颜色变化 | 比较CuS和ZnS的溶度积( )的大小 )的大小 |
| ④ | 向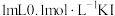 溶液中加入 溶液中加入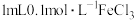 溶液,充分反应后,再加KSCN,观察溶液颜色变化 溶液,充分反应后,再加KSCN,观察溶液颜色变化 | 探究 是否完全反应 是否完全反应 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
名校
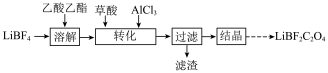
7 . 在无水无氧条件下制备二氟草酸硼酸锂LiBF2C2O4,其过程可表示如下:
(1)LiBF2C2O4可替代目前常用的锂离子电池电解质LiPF6。
已知:LiBF2C2O4的分解温度为240 ℃,LiPF6的分解温度约200 ℃;在25 ℃、潮湿环境中,两种样品的XRD图谱(可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)如图所示。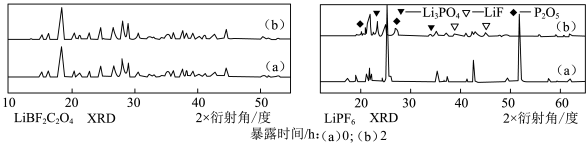
①LiPF6暴露在环境中迅速产生气体X,形成白雾。X由两种元素组成,其化学式为______ 。
②LiBF2C2O4替代LiPF6作电池电解质的优势有_______ 。
(2)“溶解”和“转化”操作在如图所示装置中进行。

①“溶解”时的操作依次为称取一定质量LiBF4置于三颈瓶中→____ (填字母)→搅拌直至完全溶解。
A.注入乙酸乙酯→充入N2→抽真空 B.抽真空→注入乙酸乙酯→充入N2
C.抽真空→充入N2→注入乙酸乙酯
②“转化”时,将草酸、催化剂AlCl3与溶剂乙酸乙酯混合,再将混合液注入三颈瓶中。保持搅拌速率不变,为防止反应过于剧烈,可采取的操作或实验条件为______ 。(写出一种)
(3)已知AlCl3在178 ℃时升华,极易水解;SOCl2熔点-105 ℃,沸点76 ℃,遇水剧烈反应生成SO2和HCl气体;AlCl3微溶于SOCl2。为获得少量无水AlCl3,请补充实验方案:向三颈瓶中加入一定质量AlCl3·6H2O晶体,常压下加入SOCl2,_____________ ,得到无水AlCl3。(实验须使用的试剂和仪器:NaOH溶液、冷凝管)

(1)LiBF2C2O4可替代目前常用的锂离子电池电解质LiPF6。
已知:LiBF2C2O4的分解温度为240 ℃,LiPF6的分解温度约200 ℃;在25 ℃、潮湿环境中,两种样品的XRD图谱(可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)如图所示。

①LiPF6暴露在环境中迅速产生气体X,形成白雾。X由两种元素组成,其化学式为
②LiBF2C2O4替代LiPF6作电池电解质的优势有
(2)“溶解”和“转化”操作在如图所示装置中进行。

①“溶解”时的操作依次为称取一定质量LiBF4置于三颈瓶中→
A.注入乙酸乙酯→充入N2→抽真空 B.抽真空→注入乙酸乙酯→充入N2
C.抽真空→充入N2→注入乙酸乙酯
②“转化”时,将草酸、催化剂AlCl3与溶剂乙酸乙酯混合,再将混合液注入三颈瓶中。保持搅拌速率不变,为防止反应过于剧烈,可采取的操作或实验条件为
(3)已知AlCl3在178 ℃时升华,极易水解;SOCl2熔点-105 ℃,沸点76 ℃,遇水剧烈反应生成SO2和HCl气体;AlCl3微溶于SOCl2。为获得少量无水AlCl3,请补充实验方案:向三颈瓶中加入一定质量AlCl3·6H2O晶体,常压下加入SOCl2,
您最近一年使用:0次
名校
解题方法
8 . 下列电解质溶液中微粒的物质的量浓度关系一定正确的是
A. 的 的 溶液(已知显酸性): 溶液(已知显酸性): |
B.等物质的量浓度的 和 和 混合溶液中: 混合溶液中: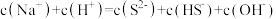 |
C.同一条件下, 相同的 相同的 溶液、 溶液、 溶液、 溶液、 溶液、 溶液、 溶液(相关酸的电离平衡常数参见第9题数据): 溶液(相关酸的电离平衡常数参见第9题数据):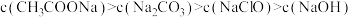 |
D.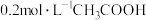 溶液和 溶液和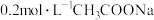 溶液等体积混合: 溶液等体积混合: |
您最近一年使用:0次
解题方法
9 . 天然气中含有的H2S会腐蚀管道设备,开采天然气后须及时除去H2S。在此过程中会产生大量含硫废水(其中硫元素的主要化合价是-2价),对设备、环境等边成严重危害。
已知:ⅰ:H2S有剧毒;常温下溶解度为1:2.6(体积)。
ⅱ:H2S、HS-、S2-在水溶液中的物质的量分数随pH的分布曲线如下图。
ⅲ:碳酸的电离平衡常数:Ka1=4.5×10-7,Ka2=4.7×10-11
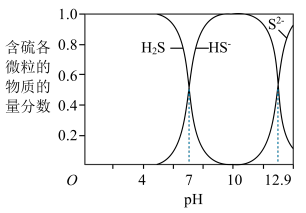
(1)用过量的Na2CO3溶液吸收天然气中的H2S的离子方程式是_________________ ,该反应对应的化学平衡常数K=________ 。
(2)①当pH≈8时,含硫废水中H2S、HS-的浓度比是_____________ 。
②NaHS溶液呈碱性,原因是__________________ 。(计算说明)。
(3)沉淀法处理含硫废水:
向pH≈9的含硫废水中加入适量Cu2+的溶液,观察到有黑色沉淀生成,则溶液的pH______ (填“升高““降低”或“不变”)。
(4)氧化还原法处理含硫废水:
向pH≈9的含硫废水中加入一定浓度的Na2SO3溶液,加酸将溶液调为pH=5,产生淡黄色沉淀。
①反应的离子方程式是_____________ 。
②不同pH时,硫化物去除率随时间的变化曲线如图所示。本工艺选择控制体系的pH=5,不选择pH<5,从环境保护的角度分析其主要原因:____________ 。

已知:ⅰ:H2S有剧毒;常温下溶解度为1:2.6(体积)。
ⅱ:H2S、HS-、S2-在水溶液中的物质的量分数随pH的分布曲线如下图。
ⅲ:碳酸的电离平衡常数:Ka1=4.5×10-7,Ka2=4.7×10-11

(1)用过量的Na2CO3溶液吸收天然气中的H2S的离子方程式是
(2)①当pH≈8时,含硫废水中H2S、HS-的浓度比是
②NaHS溶液呈碱性,原因是
(3)沉淀法处理含硫废水:
向pH≈9的含硫废水中加入适量Cu2+的溶液,观察到有黑色沉淀生成,则溶液的pH
(4)氧化还原法处理含硫废水:
向pH≈9的含硫废水中加入一定浓度的Na2SO3溶液,加酸将溶液调为pH=5,产生淡黄色沉淀。
①反应的离子方程式是
②不同pH时,硫化物去除率随时间的变化曲线如图所示。本工艺选择控制体系的pH=5,不选择pH<5,从环境保护的角度分析其主要原因:

您最近一年使用:0次
解题方法
10 . 根据下列实验操作和现象得出的结论不正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向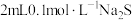 溶液中滴加 溶液中滴加  溶液至不再有沉淀产生,再滴加几滴 溶液至不再有沉淀产生,再滴加几滴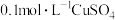 溶液,出现黑色沉淀 溶液,出现黑色沉淀 |  |
| B | 加热麦芽糖和稀 混合溶液,冷却;加入 混合溶液,冷却;加入 溶液后加入银氨溶液,加热,出现银镜 溶液后加入银氨溶液,加热,出现银镜 | 麦芽糖的水解产物中一定有还原性糖 |
| C | 用pH计测量等温等浓度的 和 和 溶液的pH,前者大于后者 溶液的pH,前者大于后者 | 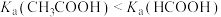 |
| D | 将石蜡油蒸气通过炽热的碎瓷片后产生的气体通入溴的四氯化碳溶液,溶液褪色 | 气体产物中含有不饱和烃 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



