名校
1 . 已知p(A)=-lgc平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
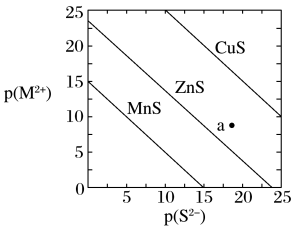

| A.a点有ZnS沉淀生成 |
| B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c平(S2-)不变 |
D.CuS和MnS共存的悬浊液中,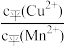 =10-20 =10-20 |
您最近一年使用:0次
2022-01-05更新
|
75次组卷
|
2卷引用:山西省运城市芮城中学2021-2022学年高二上学期12月月考化学试题
名校
2 . 室温下,将0.3molBaSO4加入5L1mol/LNa2CO3溶液中,不考虑体积变化,达到平衡时,c(SO )=0.02mol/L,下列说法错误的是
)=0.02mol/L,下列说法错误的是
 )=0.02mol/L,下列说法错误的是
)=0.02mol/L,下列说法错误的是| A.有BaCO3沉淀生成 |
| B.依据题干信息可推出:Ksp[BaSO4]<Ksp[BaCO3] |
| C.向溶液中继续加入少量Na2CO3固体,BaCO3沉淀增多 |
| D.向溶液中继续加入少量蒸馏水,BaCO3沉淀减少 |
您最近一年使用:0次
3 . 化学与生产、生活密切相关,下列说法正确的是
| A.牙膏中添加氟化物可预防龋齿 |
| B.沼气的主要成分为甲烷,沼气属于不可再生资源 |
| C.葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用 |
| D.氢氧化镁和碳酸钠可用作胃酸的中和剂 |
您最近一年使用:0次
2021-12-25更新
|
209次组卷
|
3卷引用:山西省2021-2022学年高二上学期12月联合考试化学试题
4 . 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgBr的Ksp=5×10-11,下列说法不正确的是
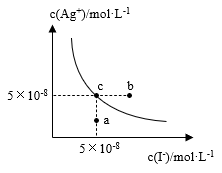

| A.在t℃时,AgI的Ksp=2.5×10-15 |
| B.图中b点有碘化银晶体析出 |
| C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 |
D.在t℃时,反应AgBr(s)+I-(aq) AgI(s)+ Br-(aq)的平衡常数K= 20000 AgI(s)+ Br-(aq)的平衡常数K= 20000 |
您最近一年使用:0次
2021-05-27更新
|
190次组卷
|
4卷引用:山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题
解题方法
5 . 已知:25℃时CaCO3的Ksp=2.8×10-9,CaF2的Ksp=2.7×10-11.现将浓度为2×10-4 mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合(忽略混合时溶液体积的变化),下列说法正确的是
| A.CaCO3难溶于稀硫酸,却能溶于醋酸,说明醋酸酸性比硫酸强 |
| B.CaCO3与水形成饱和溶液,再加CaCO3固体,平衡向溶解方向移动,Ksp将增大 |
| C.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合不会析出CaF2固体 |
| D.若要产生沉淀,则所用CaCl2溶液的浓度至少应为5.6×10-5 mol·L-1 |
您最近一年使用:0次
解题方法
6 . 在平衡体系Ca(OH)2(s) Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是
Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是
 Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是
Ca2++2OH- △H<0中,能使c(Ca2+)减小,而使c(OH-)增大的是| A.加入少量CuCl2固体 | B.加入少量NaCl固体 |
| C.加入少量K2CO3固体 | D.升高体系温度 |
您最近一年使用:0次
2021-01-25更新
|
200次组卷
|
3卷引用:山西省运城市高中联合体2020-2021学年高二上学期12月阶段性测试化学试题
山西省运城市高中联合体2020-2021学年高二上学期12月阶段性测试化学试题(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)浙江省丽水市高中发展共同体2021-2022学年高二下学期(2月)返校考试化学试题
名校
解题方法
7 . 常温下,下列溶液中各离子浓度关系正确的是
| A.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S) |
B.浓度为0.1mol·L-1的碳酸钠溶液:2c(Na+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| C.0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol·L-1盐酸③0.01mol·L-1氯化镁溶液④0.1mol·L-1硝酸银溶液中Ag+的浓度①>④=②>③ |
您最近一年使用:0次
名校
8 . 下列说法正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
| B.25℃时NaHA溶液pH<7说明H2A是强酸 |
| C.25℃时用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| D.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
您最近一年使用:0次
名校
9 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
①NaHA溶液的pH__ (填“大于”“小于”或“等于”)Na2A溶液的pH。
②某温度下,若向0.1mol•L-1的NaHA溶液中逐滴滴加0.1mol•L-1KOH溶液至溶液呈中性。此时该混合溶液中,下列关系一定正确的是__ 。
A.c(H+)•c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol•L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有__ 。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
(2)0.2mol•L-1HR溶液与0.1mol•L-1NaOH溶液等体积混合,测得混合溶液pH>7,则说明在相同条件下HR的电离程度__ (填“>”“<”或“=”)NaR的水解程度,混合溶液中各离子浓度的大小顺序为__ 。
(3)常温下,若在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___ mol•L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。
H++A2-。①NaHA溶液的pH
②某温度下,若向0.1mol•L-1的NaHA溶液中逐滴滴加0.1mol•L-1KOH溶液至溶液呈中性。此时该混合溶液中,下列关系一定正确的是
A.c(H+)•c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol•L-1
③已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)△H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
(2)0.2mol•L-1HR溶液与0.1mol•L-1NaOH溶液等体积混合,测得混合溶液pH>7,则说明在相同条件下HR的电离程度
(3)常温下,若在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
您最近一年使用:0次
名校
10 . 已知Ca(OH)2饱和溶液中存在沉淀溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个
Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个
①升高温度,该沉淀溶解平衡逆向移动
②向溶液中加入少量Na2CO3粉末能增大Ca2+浓度
③恒温条件下,向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加入Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
 Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个
Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的有几个①升高温度,该沉淀溶解平衡逆向移动
②向溶液中加入少量Na2CO3粉末能增大Ca2+浓度
③恒温条件下,向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加入Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次



