名校
1 . 化学与生产、生活息息相关。下列说法正确的是
| A.锅炉内壁安装镁合金防止受腐蚀,利用的是电解原理 |
| B.电子跃迁到激发态过程中释放能量产生紫色光,因此钾盐可用作紫色烟花的原料 |
| C.牙膏中添加氟化物用于预防龋齿是利用了氧化还原反应的原理 |
| D.食品袋中放入盛有硅胶和铁粉的透气小袋的目的是防止食物受潮、氧化 |
您最近一年使用:0次
2024-02-26更新
|
203次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 下列实验操作、现象、实验结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向两支盛有等浓度等体积 的试管中分别加入等浓度等体积的 的试管中分别加入等浓度等体积的 溶液和 溶液和 溶液 溶液 | 前者产生气泡速率快 |  的催化效果比 的催化效果比 好 好 |
| B | 取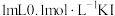 于试管中,加入 于试管中,加入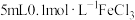 溶液,充分反应后滴入5滴15%的 溶液,充分反应后滴入5滴15%的 溶液 溶液 | 溶液变红 |  与 与 的反应有一定限度 的反应有一定限度 |
| C | 取A、B两试管,各加入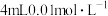 的 的 ,向A中加 ,向A中加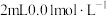 酸性高锰酸钾溶液,同时向B中加入 酸性高锰酸钾溶液,同时向B中加入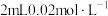 酸性高锰酸钾溶液 酸性高锰酸钾溶液 | B试管先褪为无色 | 其他条件不变时,增大反应物的浓度,反应速率加快 |
| D | 向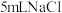 溶液中滴加2滴等浓度的 溶液中滴加2滴等浓度的 出现白色沉淀,过滤后取上层清 液又加入2滴 出现白色沉淀,过滤后取上层清 液又加入2滴 溶液 溶液 | 有黄色沉淀生成 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-24更新
|
633次组卷
|
7卷引用:江西省抚州市临川第二中学2023-2024学年高二下学期6月月考化学试题
3 . 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白( )和黄金雨中黄色的
)和黄金雨中黄色的 。室温下
。室温下 和
和 在不同的溶液中分别达到溶解平衡时,
在不同的溶液中分别达到溶解平衡时,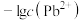 与
与 或
或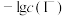 的关系如图所示:
的关系如图所示:
 )和黄金雨中黄色的
)和黄金雨中黄色的 。室温下
。室温下 和
和 在不同的溶液中分别达到溶解平衡时,
在不同的溶液中分别达到溶解平衡时,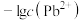 与
与 或
或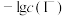 的关系如图所示:
的关系如图所示: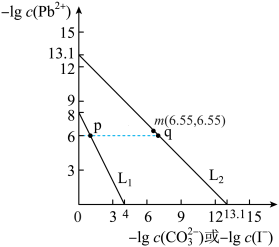
A.L1对应的是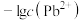 与 与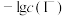 的关系变化 的关系变化 |
B.p点 的结晶速率小于其溶解速率 的结晶速率小于其溶解速率 |
C.将 浸泡到饱和KI溶液中几乎不能转化为 浸泡到饱和KI溶液中几乎不能转化为 |
| D.q点是L2对应溶液的悬浊液,通过加水可以使浊液由q点向m点方向移动 |
您最近一年使用:0次
2024-02-23更新
|
131次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期1月期末化学试题
名校
4 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中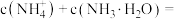
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的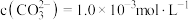 ,则
,则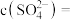
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: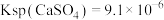 ,
,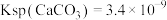
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数 | 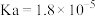 | 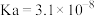 | 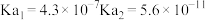 |
 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是②等浓度的
 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为(2)室温下,用
 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。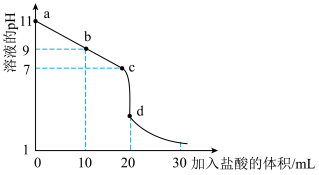
②室温下,
 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为
③b点所示的溶液中
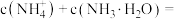
(3)工业上向锅炉里注入所得到的
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 完全转化时,混合溶液中的
完全转化时,混合溶液中的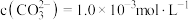 ,则
,则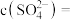
 (保留小数点后一位)。
(保留小数点后一位)。已知:
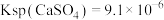 ,
,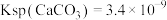
您最近一年使用:0次
2024-02-22更新
|
70次组卷
|
2卷引用:江西省上饶市第一中学2023-2024学年高二下学期开学考试化学试题
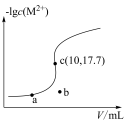
5 . 已知:常温下 ,
,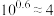 。向10
。向10 0.10
0.10
 溶液中滴加0.10
溶液中滴加0.10 的
的 溶液,滴加过程中
溶液,滴加过程中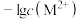 (M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
 ,
,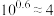 。向10
。向10 0.10
0.10
 溶液中滴加0.10
溶液中滴加0.10 的
的 溶液,滴加过程中
溶液,滴加过程中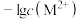 (M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
A.常温下,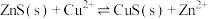 的平衡常数 的平衡常数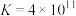 |
B.常温下, 饱和溶液中 饱和溶液中 的数量级为 的数量级为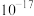 |
C.b点体系中, 的溶解速率大于其生成速率 的溶解速率大于其生成速率 |
D.若用 代替 代替 (其他不变),则c点应向下移动 (其他不变),则c点应向下移动 |
您最近一年使用:0次
2024-02-11更新
|
421次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
6 .  是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
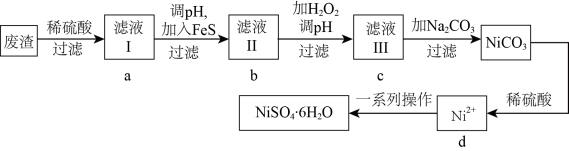
已知:各离子开始沉淀及完全沉淀时的 如表所示:
如表所示:
根据要求回答下列问题
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有______________ 种,画出基态原子的价电子轨道表示式______________ 。
(2)向滤液Ⅰ中加入 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为_______________________________________ ,当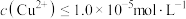 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于_____________ 。[已知: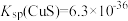 ]
]
(3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因__________________________ ;
②调节滤液Ⅱ的 ,
, 应控制在范围为
应控制在范围为__________________________ ;
③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是_______________________________________ 。
(4)滤液Ⅲ溶质的主要成分是 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是_______________________________________ 。
 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的
 如表所示:
如表所示:离子 | 开始沉淀时的 | 完全沉淀时的 |
| 6.3 | 9.7 |
| 2.2 | 3.2 |
| 6.4 | 8.4 |
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)向滤液Ⅰ中加入
 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为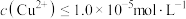 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于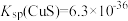 ]
](3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加
 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因②调节滤液Ⅱ的
 ,
, 应控制在范围为
应控制在范围为③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是
(4)滤液Ⅲ溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是
您最近一年使用:0次
名校
解题方法
7 . 化学与生产、生活息息相关。下列说法正确的是
| A.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
| B.在铁制品上镀铜时,铁制品所在电极发生氧化反应 |
C.在去除锅炉水垢中的 时,通常先用碳酸钠溶液浸泡,再用酸去除 时,通常先用碳酸钠溶液浸泡,再用酸去除 |
| D.用氯气和氢氧化钠制取消毒液,运用了盐类水解的原理 |
您最近一年使用:0次
2024-01-26更新
|
88次组卷
|
2卷引用:江西省新余市第一中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
8 . 下列实验操作和实验结论或目的均正确的是
选项 | 实验操作 | 实验结论或目的 |
A | 向含有酚酞的 | 证明 |
B | 等体积 | 证明HX酸性比HY强 |
C | 将氯水滴在湿润的pH试纸上,与标准比色卡对照 | 测定氯水的pH |
D | D.向 | 证明在相同温度下: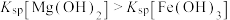 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-24更新
|
65次组卷
|
2卷引用:江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷
名校
9 . 室温下,下列实验方案能达到探究目的的是
| 选项 | 实验方案 | 探究目的 |
| A | 向盛有饱和Na2CO3溶液的试管中加入少量苯酚浊液,观察沉淀是否溶解、是否有气体生成 | 比较苯酚与碳酸的酸性强弱 |
| B | 取某有机物(无环状结构单元)与KOH溶液混合加热充分反应,冷却后取上层清液,加入硝酸酸化,再加入硝酸银溶液,观察是否有白色沉淀生成 | 该有机物中是否含有氯元素 |
| C | 将Fe3O4溶于盐酸所得溶液浓缩后,滴入酸性KMnO4溶液,观察溶液颜色的变化 | Fe3O4中是否含Fe(Ⅱ) |
| D | 用饱和Na2CO3溶液浸泡BaSO4固体,过滤,将所得固体溶于稀硝酸,观察沉淀是否溶解、是否有气体生成 | 比较Ksp(BaSO4)、Ksp(BaCO3)大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 下列离子方程式书写正确的是
| A.向Fe2O3中加入HI溶液:Fe2O3+6H+=2Fe3++H2O |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
C.足量澄清石灰水和少量NaHCO3溶液反应:2OH-+2 +Ca2+=2H2O+ +Ca2+=2H2O+ +CaCO3↓ +CaCO3↓ |
| D.向AgCl悬浊液中滴加过量的Na2S溶液:2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq) |
您最近一年使用:0次


 固体,溶液红色变浅
固体,溶液红色变浅 的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快
的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快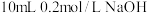 溶液中滴2滴
溶液中滴2滴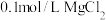 溶液,产生白色沉淀后再滴加2滴
溶液,产生白色沉淀后再滴加2滴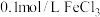 ,又生成红褐色沉淀
,又生成红褐色沉淀

