1 .  时,向
时,向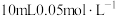 的
的 溶液中通入氨气,测得溶液中的
溶液中通入氨气,测得溶液中的 与
与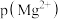 之间的变化曲线如图所示,[已知:
之间的变化曲线如图所示,[已知: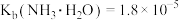 ,
,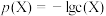 ,忽略反应过程中溶液体积的变化]。下列说法错误为是
,忽略反应过程中溶液体积的变化]。下列说法错误为是
 时,向
时,向 的
的 溶液中通入氨气,测得溶液中的
溶液中通入氨气,测得溶液中的 与
与 之间的变化曲线如图所示,[已知:
之间的变化曲线如图所示,[已知: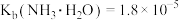 ,
,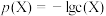 ,忽略反应过程中溶液体积的变化]。下列说法错误为是
,忽略反应过程中溶液体积的变化]。下列说法错误为是
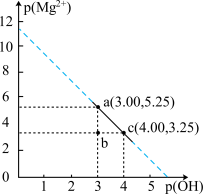
A. 点溶液满足: 点溶液满足: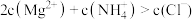 |
B.b点溶液中有 沉淀产生 沉淀产生 |
C. 点溶液中溶质有 点溶液中溶质有 、 、 、 、 |
D.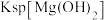 的数量级是 的数量级是 |
您最近一年使用:0次
名校
2 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
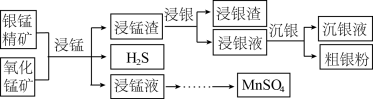
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.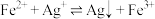 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: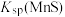
________ (填“>”或“<”)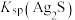 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________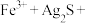 ________
________ ________
________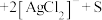
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 和
和________ 。
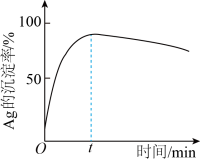
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
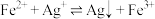 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: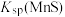
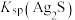 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
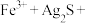 ________
________ ________
________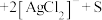
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
605次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
3 . 已知25℃物质的溶度积常数为:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS: Ksp=1.6×10-24。下列说法错误的是
| A.相同温度下,CuS的溶解度小于ZnS的溶解度 |
| B.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
| C.0.01molCuSO4完全溶解在1L 0.023mol/L的Na2S溶液中,Cu2+浓度为1.0×10-34mol/L |
| D.在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
您最近一年使用:0次
2023-11-24更新
|
261次组卷
|
2卷引用:江西省鹰潭市2023-2024学年高二上学期1月期末考试化学试题
4 . 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
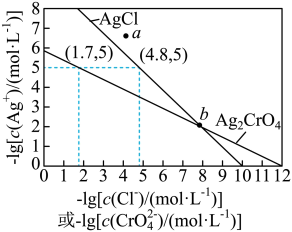
下列说法正确的是

下列说法正确的是
| A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀 |
B.b点时,c(Cl-)=c(CrO ),Ksp(AgCl)=Ksp(Ag2CrO4) ),Ksp(AgCl)=Ksp(Ag2CrO4) |
C.Ag2CrO4+2Cl- 2AgCl+CrO 2AgCl+CrO 的平衡常数K=107.9 的平衡常数K=107.9 |
| D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀 |
您最近一年使用:0次
2023-06-12更新
|
16285次组卷
|
33卷引用:江西省宜丰中学2022-2023学年高二下学期7月期末考试化学试题
江西省宜丰中学2022-2023学年高二下学期7月期末考试化学试题2023年高考全国乙卷化学真题(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国乙卷)(PPT+Word)(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南师范大学附属中学2024届高三摸底考试化学试题 (已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)河南省南阳市第一中学校2023-2024学年高三上学期第一次月考化学试题河南省南阳市南阳一中2023-2024学年高三上学期9月月考化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷重庆市南开中学校2023-2024学年高二上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)10-2023新东方高二上期中考化学(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省娄底市新化县2023-2024学年高二上学期期末考试化学试题北京市第一○一中学2023-2024学年高三下学期开学考试化学试题重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题河北i省石家庄市第二十四中学2023-2024学年高三上学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题天津市红桥区2024届高三一模化学试题河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学广西壮族自治区河池市普通高中2024届高三毕业班下学期模拟测试(二模)化学试题福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题北京市十一学校2024届高三下学期高考模拟练习化学试题
5 . 下图为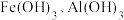 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是
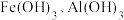 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是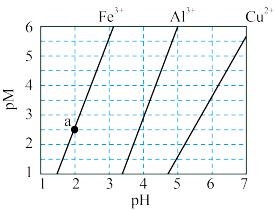
A.由 点可求得 点可求得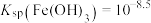 |
B. 时 时 的溶解度为 的溶解度为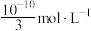 |
C.浓度均为 的 的 和 和 可通过分步沉淀进行分离 可通过分步沉淀进行分离 |
D.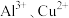 混合溶液中 混合溶液中 时二者不会同时沉淀 时二者不会同时沉淀 |
您最近一年使用:0次
2023-06-09更新
|
16976次组卷
|
33卷引用:江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷
江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷 2023年高考全国甲卷化学真题(已下线)T13-溶液中的离子平衡(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题16 水溶液中的离子平衡(已下线)2023年高考山东卷化学真题变式题(不定项选择题)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)海南省海南中学2023-2024学年高三上学期第0次月考化学试题河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)第32讲难溶电解质的溶解平衡(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析福建泉州培元中学2023-2024学年上学期高三10月月考化学试题(已下线)选择题11-16福建省福州第四中学2023-2024学年高三上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省淮北市2023-2024学年高三上学期1月调研化学试题(已下线)选择题11-15河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)天津市耀华中学2023-2024学年高二上学期1月期末化学试题天津市耀华中学2023-2024学年高二上学期期末学情调研化学试卷山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题
名校
6 . 常温下,三种金属硫化物XS、YS、ZS的饱和溶液中pM[pM= -lgc(M2+)]与pS[pS= -lgc(S2-)]的关系如图所示。已知:Ksp(XS) > Ksp(YS) > Ksp (ZS)。

| A.直线③代表ZS |
| B.Ksp (XS) =1 ×10-36 |
| C.向c点饱和溶液中加少量Na2S,c点向b点迁移 |
D.YS(s) +Z2+(aq)  ZS(s) +Y2+ (aq) K=1 ×108 ZS(s) +Y2+ (aq) K=1 ×108 |
您最近一年使用:0次
2023-06-06更新
|
185次组卷
|
3卷引用:江西省宜春市上高二中2023-2024学年高二下学期3月月考化学试题
解题方法
7 . 能正确表示下列变化的离子方程式是
A.乙醇与KMnO4酸性溶液反应:5CH3CH2OH+4 + 12H+→5CH3COO-+5H++4Mn2++11H2O + 12H+→5CH3COO-+5H++4Mn2++11H2O |
B.0.1mol ·L-1 AgNO3溶液中加入过量浓氨水:Ag++3NH3·H2O=Ag(NH3)2OH+2H2O+ |
| C.少量Mg(OH)2溶于FeCl3 溶液:3Mg(OH)2(s)+2Fe3+(aq) =2Fe(OH)3(s)+3Mg2+(aq) |
| D.H2l8O 中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
您最近一年使用:0次
解题方法
8 . 银量法滴定产生的废液、废渣中含有AgSCN、AgI等,工业上常以这些废料、废渣为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如图:
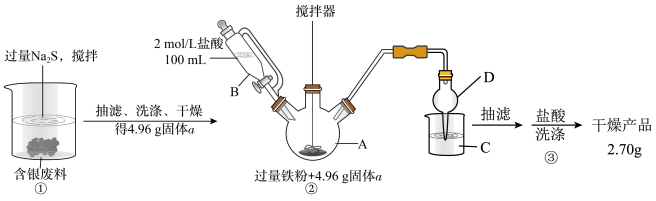
请回答下列问题:
(1)步骤①中AgSCN与Na2S反应的离子方程式为___________ ,获得沉淀时要多搅拌一段时间以获取团聚的沉淀物,该操作对后续处理的意义是___________ 。
(2)仪器B相较于分液漏斗的优点为___________ 。
(3)仪器A中物质在搅拌下充分反应后,溶液呈现浅绿色,伴有黑色不溶物产生,并生成臭鸡蛋气味气体,写出该反应的化学方程式___________ 。
(4)步骤②产生的尾气可用C装置盛装CuSO4溶液吸收,写出该反应的化学方程式___________ 。
(5)步骤③若采用稀HNO3洗涤,则产品回收率___________ (填“偏高”“偏低”或“无影响”)
(6)利用实验中给出的数据计算本次实验从固体a获得银单质的回收率为___________ 。(保留三位有效数字)

请回答下列问题:
(1)步骤①中AgSCN与Na2S反应的离子方程式为
(2)仪器B相较于分液漏斗的优点为
(3)仪器A中物质在搅拌下充分反应后,溶液呈现浅绿色,伴有黑色不溶物产生,并生成臭鸡蛋气味气体,写出该反应的化学方程式
(4)步骤②产生的尾气可用C装置盛装CuSO4溶液吸收,写出该反应的化学方程式
(5)步骤③若采用稀HNO3洗涤,则产品回收率
(6)利用实验中给出的数据计算本次实验从固体a获得银单质的回收率为
您最近一年使用:0次
9 . 工业上利用炼锌矿渣[含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4等铁的化合物]获得3种金属盐,并进一步制备半导体材料氮化镓GaN,部分工艺流程如图:
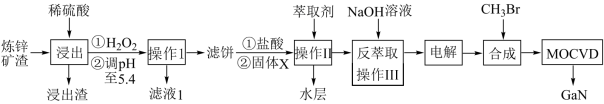
已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
②镓的化学性质与铝相似;
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为_______ , 浸取前需对矿渣粉碎的目的是_______ 。
(2)“浸出”后①中加入H2O2的离子方程式为_______ 。
(3)处理浸出液时,调节pH至5.4的目的是_______ 。
(4)萃取前,加入的固体X为_______ (填化学式)。
(5)反萃取后,镓元素的存在形式为_______ (填化学式)。
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为_______ 。
(7)滤液1中残留的镓离子的浓度为_______ mol·L-l。

已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.8 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为
(2)“浸出”后①中加入H2O2的离子方程式为
(3)处理浸出液时,调节pH至5.4的目的是
(4)萃取前,加入的固体X为
(5)反萃取后,镓元素的存在形式为
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为
(7)滤液1中残留的镓离子的浓度为
您最近一年使用:0次
10 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验现象 | 结论 |
| A | 比较元素的非金属性 | 向饱和的硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液,无气泡冒出 | 非金属性:C>B |
| B | 比较KMnO4、Cl2 和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性: KMnO4> Cl2> Fe3+ |
| C | 向1 mL 0.1 mol·L-1的MgCl2溶液中滴加2mL0.2mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 白色沉淀转化成红褐色沉淀 | Ksp[Mg(OH)2]> Ksp[(Fe(OH)3] |
| D | 检验溶液中是否含有钠元素 | 用玻璃棒蘸取该溶液在酒精灯外焰上灼烧,火焰呈黄色 | 该溶液中含有钠元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



