名校
1 . 下列实验装置(部分夹持装置已略去)能达到对应实验目的的是


| A.用图甲测定中和热 |
| B.用装置乙作为分馏的接收装置 |
C.图丙比较 和 和 溶解度大小 溶解度大小 |
| D.图丁探究铁的吸氧腐蚀 |
您最近一年使用:0次
2 . 下列实验操作能达到实验目的的是
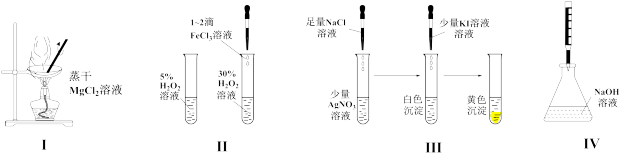

| A.装置I:从MgCl2溶液中提取MgCl2·6H2O固体 |
| B.装置II:探究催化剂对化学反应速率的影响 |
| C.装置III:验证AgCl和AgI的Ksp大小 |
| D.装置IV:用标准盐酸溶液滴定NaOH溶液的浓度 |
您最近一年使用:0次
2021-12-19更新
|
378次组卷
|
4卷引用:江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷
名校
解题方法
3 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 制备Fe(OH)3胶体 | 将FeCl3溶液加入稀氨水中并加热煮沸 |
| B | 比较Cu(OH)2、Mg(OH)2溶解度的大小 | 向10mL0.1mol/LNaOH溶液中先加入1mL0.1mol/LMgCl2溶液,再加入1mL0.1mol/LCuCl2溶液 |
| C | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
| D | 比较碳酸和硅酸的酸性强弱 | 石灰石与浓盐酸混合共热,将所得气体通入硅酸钠溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-09更新
|
196次组卷
|
5卷引用:江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题
江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题黑龙江省青冈县第一中学校2022届高三上学期第一次模拟考试化学试题吉林省长春市第二十九中学2022届高三上学期第二次质量检测化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14
名校
4 . 下列实验能达到相应的实验目的的是
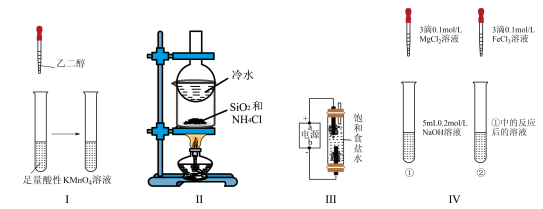

| A.I将乙二醇转化为乙二酸 |
| B.II分离SiO2和NH4Cl |
| C.III制备少量含NaClO的消毒液 |
| D.IV证明该温度下溶度积常数:Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
您最近一年使用:0次
2020-11-09更新
|
307次组卷
|
3卷引用:江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题
2013·山东济南·一模
名校
5 . 下列实验操作及现象能够达到对应实验目的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下 Ksp(BaCO3)>Ksp(BaSO4) |
| C | 常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH |
| D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的石灰水,石灰水变浑浊 | 检验气体产物CO2的存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-03-02更新
|
246次组卷
|
5卷引用:2016届江西师范大学附属中学高三上学期期末化学试卷
2016届江西师范大学附属中学高三上学期期末化学试卷(已下线)2013届山东省济南市高三3月模拟考试理综化学试卷2017届陕西省西安一中高三上期中化学试卷四川省雅安中学2018届高三下学期第一次月考化学试题2020届高三化学选修4二轮专题练——沉淀溶解平衡的影响因素及应用【精编23题】
名校
6 . 下列设计的实验方案能达到相应实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·Lˉ1CuSO4溶液,迅速产生较多气泡 |
C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
D | 通过观察液面差判断该装置的气密性 |  向里推注射器 向里推注射器 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-04-13更新
|
561次组卷
|
3卷引用:2017届江西师范大学附属中学高三3月月考理综化学试卷
名校
7 . 下列实验操作、现象及结论均正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 以 为电极,以酸化的 为电极,以酸化的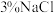 溶液作电解质溶液,连接成原电池装置,过一段时间,从 溶液作电解质溶液,连接成原电池装置,过一段时间,从 电极区域取少量溶液于试管中,再向试管中滴入2滴 电极区域取少量溶液于试管中,再向试管中滴入2滴 溶液,观察现象 溶液,观察现象 | 探究金属的电化学保护法 |
| B | 向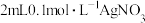 溶液中先滴加4滴 溶液中先滴加4滴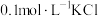 溶液,再滴加4滴 溶液,再滴加4滴 溶液。先产生白色沉淀,再产生黄色沉淀 溶液。先产生白色沉淀,再产生黄色沉淀 |  转化为 转化为 , , 溶解度小于 溶解度小于 溶解度 溶解度 |
| C | 向某溶液中滴加浓盐酸,将产生气体通入石蕊试液,溶液先变红后褪色 | 溶液中含有 或 或 |
| D | 室温下,测定浓度均为 的 的 与 与 溶液的 溶液的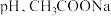 溶液的 溶液的 大 大 | 结合 的能力: 的能力: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-07更新
|
83次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)
名校
解题方法
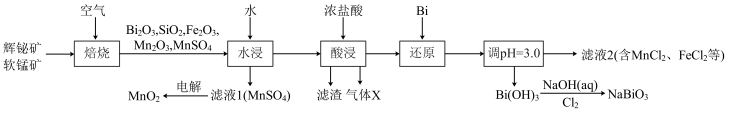
8 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性: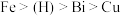 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
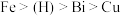 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
9 . 氧化钴(Co2O3)在工业、电子、电讯等领域都有着广阔的应用前景。以铜钴矿石[主要成分为CoO(OH),CoCO3、Cu2(OH)2CO3和 SiO2,还有少量Fe、Mg、Ca的氧化物]为原料制备氧化钴(Co2O3)的工艺流程如图所示:

已知:常温下:Ksp(FeS)=6.3×10-18 Ksp(CuS)=6.3×10-36 Ksp(CaF2)=4.0×10-11 Ksp(MgF2)=9.0×10-11。
回答下列问题:
(1)写出“浸泡”过程中CoO(OH)与Na2SO3反应的离子方程式_______ 。
(2)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式_______ 。
(3)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,_______ 。
(4)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为_______ mol·L-1(溶液中离子浓度小于1×10-5 mol·L-1视为该离子沉淀完全)。
(5)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是_______ 。

已知:常温下:Ksp(FeS)=6.3×10-18 Ksp(CuS)=6.3×10-36 Ksp(CaF2)=4.0×10-11 Ksp(MgF2)=9.0×10-11。
回答下列问题:
(1)写出“浸泡”过程中CoO(OH)与Na2SO3反应的离子方程式
(2)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”过程的离子方程式
(3)检验过程Ⅰ所得滤液中铁元素的离子已被完全沉淀的实验操作及现象:取少量待测液于试管中,
(4)常温下,在过程Ⅱ中加入足量的NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时F-的浓度至少为
(5)过程Ⅲ中加入Na2CO3得到滤渣后又加入盐酸溶解,其目的是
您最近一年使用:0次
名校
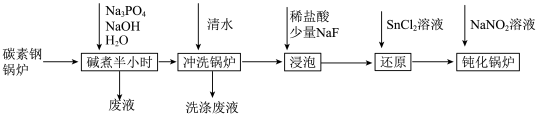
10 . 工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________ 。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________ ;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________ 。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________ (填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________ 。

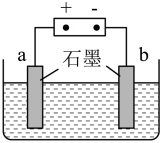
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________ 。

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.1×10-5 | 5.6×10-12 | 6.8×10-6 | 2.1×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为

您最近一年使用:0次
2019-03-06更新
|
1213次组卷
|
3卷引用:江西省赣州市信丰中学2020-2021学年高三上学期第五次月考化学试题



