名校
1 . 锂离子电池的应用很广泛,某种锂电池的正极材料为钴酸锂,该材料可以由海水(含较大浓度的LiCI及少量MgCl2、CaCl2、MnCl2等)为原料制备,其工艺流程如图所示:
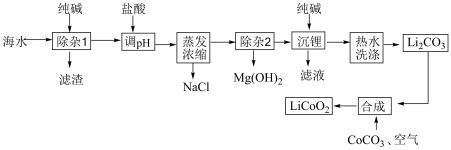
已知:①在常温下几种难溶物质的溶度积常数如表
②Li2CO3微溶于热水,可溶于冷水。回答下列问题:
(1)“除杂1”步骤中除去的杂质离子为Mg2+和_____ 。
(2)“调pH”的目的是_____ 。
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作_____ 。
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为_____ 。(结果保留2位有效数字)
(5)“热水洗涤”的目的是_____ 。在实验室里洗涤Li2CO3时会采用如图所示装置,该装置较于普通过滤装置的优点为_____ 。
(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式_____ 。

已知:①在常温下几种难溶物质的溶度积常数如表
| 物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
| K | 2.5×10-2 | 6.8×10-6 | 3.4×10-9 | 2.3×10-11 | 5.6×10-12 |
(1)“除杂1”步骤中除去的杂质离子为Mg2+和
(2)“调pH”的目的是
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为
(5)“热水洗涤”的目的是

(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式
您最近一年使用:0次
解题方法
2 . 实验室用绿矾(FeSO4·7H2O,M=278g/mol)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe,M=204g/mol]。
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验步骤:
1.配制220mL0.800mol·L-1FeSO4溶液,取200mL于烧杯中,并向其中缓慢加入200mL2.000mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀FeCO3。
ii.实验装置如图所示(夹持和加热仪器略去),将i得到的沉淀和甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。

iii.反应结束后过滤,将滤液进行蒸发浓缩,加入无水乙醇,过滤、洗涤并干燥,得到产品24.480g。
回答下列问题:
(1)配制FeSO4溶液,用到的玻璃仪器除量筒、烧杯、胶头滴管之外,还必须使用的仪器有________ 。需要用电子天平(精确到0.001g)称量绿矾________ g。
(2)实验i中生成沉淀的化学方程式为________ ,洗涤沉淀的操作是________ 。
(3)A中反应的离子方程式为________ ,表明C中空气被排尽的实验现象是________ 。
(4)C装置中加入柠檬酸溶液的作用是防止Fe2+被氧化和________ 。
(5)步骤ⅲ中加入无水乙醇的作用是________ 。
(6)该实验产率为________ 。
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验步骤:
1.配制220mL0.800mol·L-1FeSO4溶液,取200mL于烧杯中,并向其中缓慢加入200mL2.000mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀FeCO3。
ii.实验装置如图所示(夹持和加热仪器略去),将i得到的沉淀和甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。

iii.反应结束后过滤,将滤液进行蒸发浓缩,加入无水乙醇,过滤、洗涤并干燥,得到产品24.480g。
回答下列问题:
(1)配制FeSO4溶液,用到的玻璃仪器除量筒、烧杯、胶头滴管之外,还必须使用的仪器有
(2)实验i中生成沉淀的化学方程式为
(3)A中反应的离子方程式为
(4)C装置中加入柠檬酸溶液的作用是防止Fe2+被氧化和
(5)步骤ⅲ中加入无水乙醇的作用是
(6)该实验产率为
您最近一年使用:0次
名校
解题方法
3 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
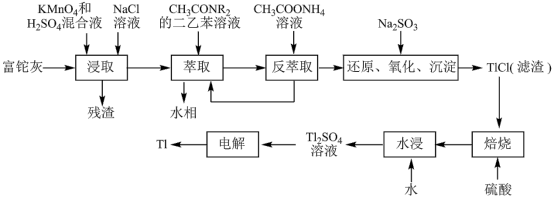
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
765次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
名校
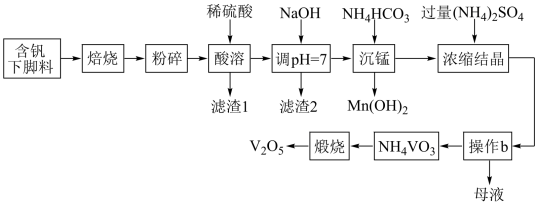
4 . V2O5是硫酸生产中的催化剂,某种含钒工业下脚料主要成分是V2O3,其中含铝、硅、铜、锰等氧化物及油脂等杂质,一种以该下脚料为原料提取V2O5的工艺流程如下:
已知:i.V2O5+2H+=2VO +H2O;VO
+H2O;VO +H2O⇌VO
+H2O⇌VO +2H+。
+2H+。
ii.常温时,有关氢氧化物的溶度积常数如下表:
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是_______ 。
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是_______ 。
(3)“滤渣1”的主要成分是_______ (写化学式),“调pH=7”,析出沉淀后,滤液中c(Cu2+):c(Al3+)=_______ 。
(4)“沉锰”反应的离子方程式是_______ 。
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是_______ 。
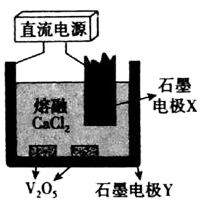
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:
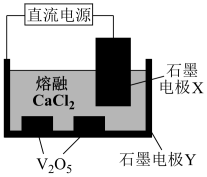
石墨电极Y接直流电源_______ (填“正极”或“负极”),阴极反应式是_______ 。

已知:i.V2O5+2H+=2VO
 +H2O;VO
+H2O;VO +H2O⇌VO
+H2O⇌VO +2H+。
+2H+。ii.常温时,有关氢氧化物的溶度积常数如下表:
| 氢氧化物 | Mn(OH)2 | Cu(OH)2 | Al(OH)3 |
| Ksp | 4.00×10-14 | 2.20×10-20 | 1.90×10-33 |
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是
(3)“滤渣1”的主要成分是
(4)“沉锰”反应的离子方程式是
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:

石墨电极Y接直流电源
您最近一年使用:0次
5 . 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
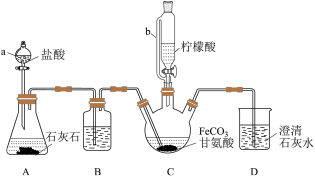
查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
Ⅰ.装置C中盛有17.4 g FeCO3和200 mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中空气排干净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)与a相比,仪器b的优点是_______ 。
(2)装置B中盛有的试剂是_______ ;装置D的作用是_______ 。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_______ 。
(4)过程Ⅰ加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,其原因是_______ 。
②柠檬酸的作用还有_______ 。
(5)过程Ⅱ中加入无水乙醇的目的是_______ 。
(6)本实验制得15.3 g甘氨酸亚铁,则其产率是_______ %。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
Ⅰ.装置C中盛有17.4 g FeCO3和200 mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中空气排干净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)与a相比,仪器b的优点是
(2)装置B中盛有的试剂是
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为
(4)过程Ⅰ加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,其原因是
②柠檬酸的作用还有
(5)过程Ⅱ中加入无水乙醇的目的是
(6)本实验制得15.3 g甘氨酸亚铁,则其产率是
您最近一年使用:0次
名校
6 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度:
(1)实验室可用下图装置制备亚硝酰氯(ClNO);
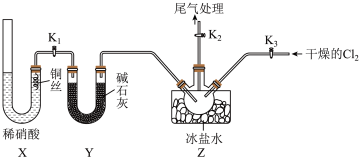
①X装置的优点为_________________________ 。
②检验装置气密性并装入药品,打开k2,然后再打开________ (填“k1”“k2”或“k3”),
通入一段时间气体,(其目的为________________________________________ ),然后进行其它操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为__________________ 。
(2)亚硝酰氯(ClNO)的纯度测定:取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12),则亚硝酰氯(ClNO)的质量分数为_________ (用代数式表示)。
(1)实验室可用下图装置制备亚硝酰氯(ClNO);

①X装置的优点为
②检验装置气密性并装入药品,打开k2,然后再打开
通入一段时间气体,(其目的为
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为
(2)亚硝酰氯(ClNO)的纯度测定:取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12),则亚硝酰氯(ClNO)的质量分数为
您最近一年使用:0次
2020-10-10更新
|
221次组卷
|
3卷引用:江西省南昌市第二中学2021届高三上学期第三次考试化学试题
名校
解题方法
7 . V2O5是硫酸生产中的催化剂,某种含钒工业下脚料主要成分是V2O3,其中含铝、硅、铜、锰等氧化物及油脂等杂质,一种以该下脚料为原料提取V2O5的工艺流程如下:
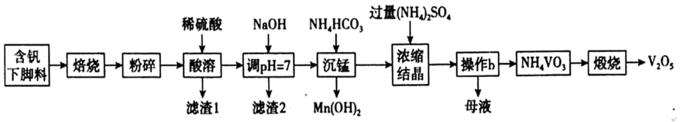
已知:i.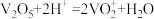 ;
;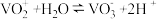 。
。
ii.常温时,有关氢氧化物的溶度积常数如下表:

回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是_______________________________________ 。
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是______________________________ 。
(3)“滤渣1”的主要成分是____________ (写化学式),“调pH=7”,析出沉淀后,滤液中c(Cu2+):c(Al3+)=____________ 。
(4)“沉锰”操作需微热,微热的目的是______________________________ ,该反应的离子方程式是________________________________________ 。
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是_______________ 。
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:石墨电极Y接直流电池___________ (填“正极”或“负极”),阴极反应式是_________________________ 。

已知:i.
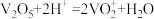 ;
;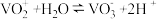 。
。ii.常温时,有关氢氧化物的溶度积常数如下表:

回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是
(2)将焙烧冷却后的固体残留物进行“粉碎”,其目的是
(3)“滤渣1”的主要成分是
(4)“沉锰”操作需微热,微热的目的是
(5)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是
(6)利用制得的V2O5可通过电解的方法制备金属钒,电解装置如图:石墨电极Y接直流电池

您最近一年使用:0次
2020-10-10更新
|
364次组卷
|
4卷引用:江西省南昌市第二中学2021届高三上学期第三次考试化学试题
江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫江西省靖安中学2021届高三上学期第四次月考化学试题百校联盟2021届高三高考9月份联考化学试题
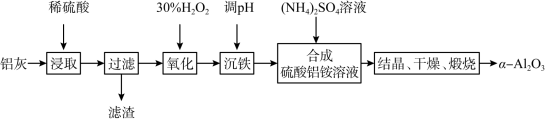
8 . 以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:_____ (填选项编号)。___________________________________ 。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
为保证产品的纯度,可以选用下列物质中的_______ 调节溶液pH(填字母),调节pH的范围为______________ 。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3____________ (填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________ 。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________ 。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________ 。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________ mol·L-1(填具体数字计算式,不必化简)

(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
| Fe3+ | Fe2+ | Al3+ | |
| 开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
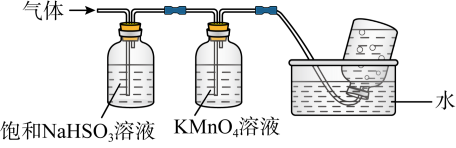
②装有KMnO4溶液洗气瓶的作用是
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=
您最近一年使用:0次
2018-12-17更新
|
288次组卷
|
2卷引用:【校级联考】江西省上饶市弋阳县第一中学等六校2018-2019学年高二(课改班)上学期12月联考化学试题
名校
解题方法
9 . 金属镁性质活泼,能与许多物质反应。
I.某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
(1)实验中,装置依次连按的顺序为A_____ (填字母序号);装置B的作用是______ ;
(2)用来检验N2的实验装置为____ (填字母序号);
(3)设计实验证明:产物中存在Mg3N2、____ ;
Ⅱ.工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为_____ 。
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)_______ ;_______ 。
I.某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。已知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
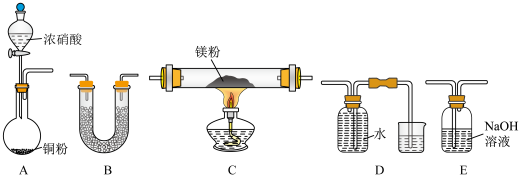
(1)实验中,装置依次连按的顺序为A
(2)用来检验N2的实验装置为
(3)设计实验证明:产物中存在Mg3N2、
Ⅱ.工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)
您最近一年使用:0次
2017-05-05更新
|
306次组卷
|
3卷引用:江西省重点中学盟校2017届高三第二次联考理综化学试题



