名校
1 . 下列表中实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向含有酚酞的 溶液中加入少量 溶液中加入少量 固体 固体 | 有白色沉淀生成,溶液红色变浅 | 纯碱溶液呈碱性是由 水解引起 水解引起 |
| B | 向盛有2mL NaOH溶液的试管中滴加4~5滴 NaOH溶液的试管中滴加4~5滴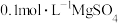 溶液,再向其中滴加 溶液,再向其中滴加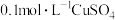 溶液 溶液 | 先生成白色沉淀,后生成蓝色沉淀 | 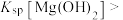  |
| C | 常温下,用玻璃棒蘸取某浓度NaOH溶液滴在湿润的pH试纸中央,与标准比色卡对比 | pH为13 | 该NaOH溶液的浓度为 |
| D | 分别取两支洁净的试管,甲试管中加入10mL 溶液,乙试管中加入5mL 溶液,乙试管中加入5mL 溶液和5mL蒸馏水,然后同时向两支试管中加入10mL 溶液和5mL蒸馏水,然后同时向两支试管中加入10mL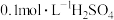 溶液 溶液 | 甲试管出现浑浊的时间更短 | 增大 浓度,可以加快反应速率 浓度,可以加快反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-08更新
|
88次组卷
|
2卷引用:江西省丰城中学2022-2023学年高二下学期入学考试化学试题
解题方法
2 . 下列有关实验操作和现象与结论对应关系正确的是
| 选项 | 操作和现象 | 结论 |
| A | 向 溶液中加入足量硝酸,将产生的气体通入 溶液中加入足量硝酸,将产生的气体通入 溶液中,产生白色沉淀 溶液中,产生白色沉淀 | 非金属性:N>C>Si |
| B | 向酸性 溶液中滴加丙烯醇( 溶液中滴加丙烯醇(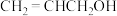 )并振荡,溶液褪色。 )并振荡,溶液褪色。 | 丙烯醇中含有醇羟基 |
| C | 向某待测液中滴加少量 ,再加入几滴KSCN溶液,溶液变为血红色 ,再加入几滴KSCN溶液,溶液变为血红色 | 待测液中一定含Fe3+ |
| D | 向10滴  溶液中,先滴入 溶液中,先滴入 的NaCl溶液,至不再有白色沉淀生成。再滴入 的NaCl溶液,至不再有白色沉淀生成。再滴入 的NaI溶液,白色沉淀转化为黄色沉淀。 的NaI溶液,白色沉淀转化为黄色沉淀。 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度小于水解程度 在水中的电离程度小于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 向浓度均为0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
676次组卷
|
8卷引用:江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题
江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题广东省梅州市兴宁市沐彬中学2021-2022学年高二下学期期中考试化学试题
18-19高三上·江西南昌·阶段练习
解题方法
4 . 下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有漂白粉溶液的试管中加浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
| B | 向SO2水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO4 |
| C | 使装有NO2气体的密闭容器减小体积 | 气体颜色先变深、而后变浅 | 气体颜色变浅原因是:2NO2⇋N2O4 |
| D | 先向2mL 0.1mol/L Na2S溶液中滴入几滴0.1mol/L ZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
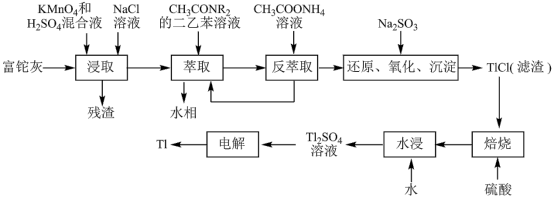
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
760次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
解题方法
6 . 钨有“烈火金刚”的美称,以其高熔点、高比重、高硬度的特点,广泛应用于机械加工、冶金、采矿行业、电光源、建筑工业、兵器工业、航天航空等领域,是一种重要的战略资源,可以说没有钨就没有发达的现代工业。含钨的矿物有黑钨矿和白钨矿,白钨矿主要含CaWO4、Fe2O3、SiO2等,从白钨矿提取钨的工艺流程如下图所示。
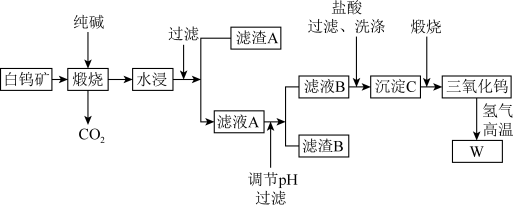
(1)写出CaWO4在煅烧时生成Na2WO4发生反应的化学方程式:_______ 。
(2)在“水浸”时,为加快浸出速率,写出一种可以采取的措施:_______ 。
(3)写出滤渣A的一种用途_______ 。
(4)调节pH的目的:_______ 。
(5)洗涤沉淀C的操作为:_______ 。
(6)为了获取高纯度的金属钨,不宜用碳而必须用氢气做还原剂的原因除了碳和金属钨在高温下会反应生成碳化钨,还存在的原因有_______ (写出一种合理的原因即可)。
(7)钨酸的酸性很弱,难溶于水,写出往滤液B中加入盐酸所发生的反应离子方程式:_______ 。

(1)写出CaWO4在煅烧时生成Na2WO4发生反应的化学方程式:
(2)在“水浸”时,为加快浸出速率,写出一种可以采取的措施:
(3)写出滤渣A的一种用途
(4)调节pH的目的:
(5)洗涤沉淀C的操作为:
(6)为了获取高纯度的金属钨,不宜用碳而必须用氢气做还原剂的原因除了碳和金属钨在高温下会反应生成碳化钨,还存在的原因有
(7)钨酸的酸性很弱,难溶于水,写出往滤液B中加入盐酸所发生的反应离子方程式:
您最近一年使用:0次
解题方法
7 . 钨是熔点最高的金属,在国民经济和国防军工领域具有重要用途。工业上用白钨矿(主要成分是CaWO4)生产金属钨粉的流程如图:
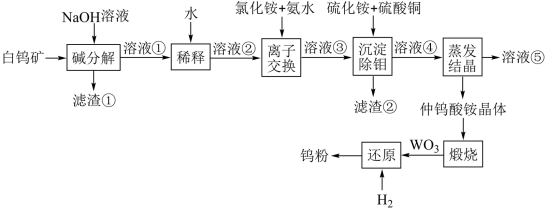
请根据上述流程回答以下问题:
(1)白钨矿与氢氧化钠反应的其中一个产物是可溶于水的钨酸钠,写出该化学反应方程式:_____ 。
(2)溶液②为钨酸钠溶液,经离子交换后得到溶液③为钨酸铵溶液,该过程中加入氨水的作用是调节溶液的pH和_____ 。
(3)溶液④为钨酸铵溶液,其经过蒸发结晶后得到仲钨酸铵[(NH4)10W12O41·5H2O]晶体,结晶过程中钨酸铵溶液没有完全蒸干,还得到溶液⑤,主要原因是_____ 。
(4)溶液⑤进入“离子交换”中循环使用,其目的为_____ (填编号)。
A.转变为钨酸铵 B.回收硫酸铵 C.提升钨的收率 D.富集钨元素
(5)请写出仲钨酸铵煅烧分解的反应方程式:_____ 。
(6)“沉淀除钼”,先加入硫化铵,把钼酸铵转化为硫代钼酸铵,再加入硫酸铜。加入硫酸铜溶液的作用是_____ 。(填编号)。
A.生成CuS沉淀,除去多余的硫化铵
B.生成硫代钼酸铜沉淀而除去
C.生成更多的钨酸铵
D.氧化钼酸铵,形成沉淀而除去
(7)用氢气或Al均可还原WO3,为得到纯度较高的产品,应选择的方法是_____ (填“氢气还原”或“Al还原”)。

请根据上述流程回答以下问题:
(1)白钨矿与氢氧化钠反应的其中一个产物是可溶于水的钨酸钠,写出该化学反应方程式:
(2)溶液②为钨酸钠溶液,经离子交换后得到溶液③为钨酸铵溶液,该过程中加入氨水的作用是调节溶液的pH和
(3)溶液④为钨酸铵溶液,其经过蒸发结晶后得到仲钨酸铵[(NH4)10W12O41·5H2O]晶体,结晶过程中钨酸铵溶液没有完全蒸干,还得到溶液⑤,主要原因是
(4)溶液⑤进入“离子交换”中循环使用,其目的为
A.转变为钨酸铵 B.回收硫酸铵 C.提升钨的收率 D.富集钨元素
(5)请写出仲钨酸铵煅烧分解的反应方程式:
(6)“沉淀除钼”,先加入硫化铵,把钼酸铵转化为硫代钼酸铵,再加入硫酸铜。加入硫酸铜溶液的作用是
A.生成CuS沉淀,除去多余的硫化铵
B.生成硫代钼酸铜沉淀而除去
C.生成更多的钨酸铵
D.氧化钼酸铵,形成沉淀而除去
(7)用氢气或Al均可还原WO3,为得到纯度较高的产品,应选择的方法是
您最近一年使用:0次
名校
8 . 下列解释物质用途的反应方程式不正确的是
A.用Fe2(SO4)3净水:Fe3+ + 3H2O Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
| B.用Na2S处理含Hg2+废水:Hg2+ + S2-=HgS↓ |
C.用Na2CO3溶液处理水垢中的CaSO4:Ca2+ +  =CaCO3↓ =CaCO3↓ |
D.燃煤时加入石灰石,减少SO2排放:2CaCO3 + 2SO2 + O2 2CaSO4 + 2CO2 2CaSO4 + 2CO2 |
您最近一年使用:0次
2016-12-09更新
|
918次组卷
|
3卷引用:江西省吉安市第三中学2022-2023学年高一上学期期末考试化学试题



