名校
解题方法
1 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: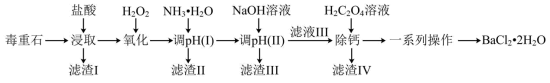
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近一年使用:0次
解题方法
2 .  是生产多晶硅的副产物,遇水剧烈水解。利用
是生产多晶硅的副产物,遇水剧烈水解。利用 对废旧的锂电池正极材料
对废旧的锂电池正极材料 进行焙烧氯化处理(生成
进行焙烧氯化处理(生成 ),以回收
),以回收 ,工艺流程如图所示。
,工艺流程如图所示。

下列说法错误的是
 是生产多晶硅的副产物,遇水剧烈水解。利用
是生产多晶硅的副产物,遇水剧烈水解。利用 对废旧的锂电池正极材料
对废旧的锂电池正极材料 进行焙烧氯化处理(生成
进行焙烧氯化处理(生成 ),以回收
),以回收 ,工艺流程如图所示。
,工艺流程如图所示。
下列说法错误的是
A.“ 焙烧”时,加入 焙烧”时,加入 的作用是作还原剂 的作用是作还原剂 |
B.焙烧后应先除去过量的 ,避免水浸时产生大量白雾 ,避免水浸时产生大量白雾 |
C.“滤饼1”的主要成分是 |
D.“沉锂”时,发生反应的离子方程式为 |
您最近一年使用:0次
名校
3 . 下列反应的离子方程式书写正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=2HClO+CO |
B.用纯碱溶液转化水垢中的CaSO4:CO (aq)+CaSO4(s)=SO (aq)+CaSO4(s)=SO (aq)+CaCO3(s) (aq)+CaCO3(s) |
C.磁性氧化铁溶于稀HNO3:Fe3O4+12H++NO =3Fe3++NO↑+6H2O =3Fe3++NO↑+6H2O |
D.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
您最近一年使用:0次
名校
4 . 下列实验操作、现象及结论均正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 以 为电极,以酸化的 为电极,以酸化的 溶液作电解质溶液,连接成原电池装置,过一段时间,从 溶液作电解质溶液,连接成原电池装置,过一段时间,从 电极区域取少量溶液于试管中,再向试管中滴入2滴 电极区域取少量溶液于试管中,再向试管中滴入2滴 溶液,观察现象 溶液,观察现象 | 探究金属的电化学保护法 |
| B | 向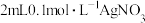 溶液中先滴加4滴 溶液中先滴加4滴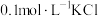 溶液,再滴加4滴 溶液,再滴加4滴 溶液。先产生白色沉淀,再产生黄色沉淀 溶液。先产生白色沉淀,再产生黄色沉淀 |  转化为 转化为 , , 溶解度小于 溶解度小于 溶解度 溶解度 |
| C | 向某溶液中滴加浓盐酸,将产生气体通入石蕊试液,溶液先变红后褪色 | 溶液中含有 或 或 |
| D | 室温下,测定浓度均为 的 的 与 与 溶液的 溶液的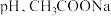 溶液的 溶液的 大 大 | 结合 的能力: 的能力: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-07更新
|
83次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)
名校
解题方法
5 . 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含金属单质 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
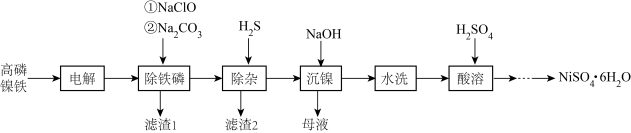
(1)“电解”时,选用 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作___________ (填“阳极”或“阴极”);另一极的主要电极反应为:_____________________ 。此外,溶液中的 有部分在阴极放电。
有部分在阴极放电。
(2)“沉镍”时,离子方程式为___________________________________________ ,为确保镍沉淀完全,理论上应调节溶液
_____________ (已知:在该工业环境下, ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)已知: 时,
时, 、
、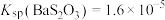 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为________ 。
(4)从 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:___________ 、__________ 、过滤、洗涤、干燥。
 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
(1)“电解”时,选用
 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作 有部分在阴极放电。
有部分在阴极放电。(2)“沉镍”时,离子方程式为

 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)已知:
 时,
时, 、
、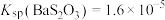 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为(4)从
 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:
您最近一年使用:0次
2024-03-01更新
|
109次组卷
|
2卷引用:江西省上饶市2023-2024学年高二上学期期末教学质量测试化学试卷
6 . 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白( )和黄金雨中黄色的
)和黄金雨中黄色的 。室温下
。室温下 和
和 在不同的溶液中分别达到溶解平衡时,
在不同的溶液中分别达到溶解平衡时,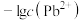 与
与 或
或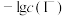 的关系如图所示:
的关系如图所示:
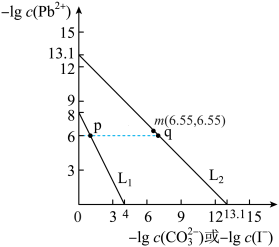
下列说法错误的是
 )和黄金雨中黄色的
)和黄金雨中黄色的 。室温下
。室温下 和
和 在不同的溶液中分别达到溶解平衡时,
在不同的溶液中分别达到溶解平衡时,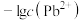 与
与 或
或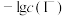 的关系如图所示:
的关系如图所示:
下列说法错误的是
A.L1对应的是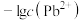 与 与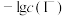 的关系变化 的关系变化 |
B.p点 的结晶速率小于其溶解速率 的结晶速率小于其溶解速率 |
C.将 浸泡到饱和KI溶液中几乎不能转化为 浸泡到饱和KI溶液中几乎不能转化为 |
| D.q点是L2对应溶液的悬浊液,通过加水可以使浊液由q点向m点方向移动 |
您最近一年使用:0次
2024-02-23更新
|
125次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期1月期末化学试题
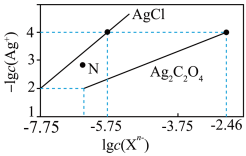
7 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为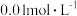 的
的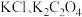 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为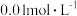 的
的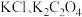 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是 
A.Ksp(Ag2C2O4)的数量级为 |
B. 点表示 点表示 的过饱和溶液 的过饱和溶液 |
C.向c(Cl-)=c(C2O )的混合溶液中滴入 )的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.常温下,Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O 2AgCl(s)+C2O 的平衡常数为108.04 的平衡常数为108.04 |
您最近一年使用:0次
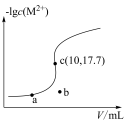
8 . 已知:常温下 ,
,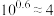 。向10
。向10 0.10
0.10
 溶液中滴加0.10
溶液中滴加0.10 的
的 溶液,滴加过程中
溶液,滴加过程中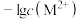 (M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
 ,
,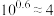 。向10
。向10 0.10
0.10
 溶液中滴加0.10
溶液中滴加0.10 的
的 溶液,滴加过程中
溶液,滴加过程中 (M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
(M表示金属)与加入的溶液体积(V)的关系如图所示,下列说法正确的是
A.常温下,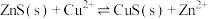 的平衡常数 的平衡常数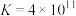 |
B.常温下, 饱和溶液中 饱和溶液中 的数量级为 的数量级为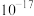 |
C.b点体系中, 的溶解速率大于其生成速率 的溶解速率大于其生成速率 |
D.若用 代替 代替 (其他不变),则c点应向下移动 (其他不变),则c点应向下移动 |
您最近一年使用:0次
2024-02-11更新
|
410次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期1月月考化学试题
名校
9 . 室温下,下列实验方案能达到探究目的的是
实验方案 | 探究目的 | |
A | 将 | 温度升高, |
B | 向 | 除去 |
C | 取两份等量的新制氯水,分别滴加 | 证明氯气与水的反应是可逆反应 |
D | 向同浓度 | 比较 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-10更新
|
106次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期1月期末化学试题
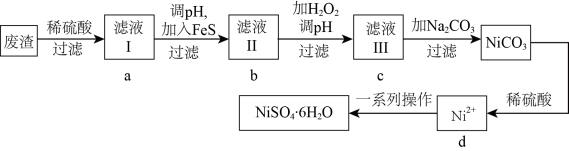
10 .  是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的 如表所示:
如表所示:
根据要求回答下列问题
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有______________ 种,画出基态原子的价电子轨道表示式______________ 。
(2)向滤液Ⅰ中加入 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为_______________________________________ ,当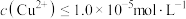 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于_____________ 。[已知: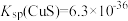 ]
]
(3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因__________________________ ;
②调节滤液Ⅱ的 ,
, 应控制在范围为
应控制在范围为__________________________ ;
③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是_______________________________________ 。
(4)滤液Ⅲ溶质的主要成分是 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是_______________________________________ 。
 是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素的化合物杂质)为原料获得。操作步骤如图:
已知:各离子开始沉淀及完全沉淀时的
 如表所示:
如表所示:离子 | 开始沉淀时的 | 完全沉淀时的 |
| 6.3 | 9.7 |
| 2.2 | 3.2 |
| 6.4 | 8.4 |
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)向滤液Ⅰ中加入
 固体是为了生成更难溶于水的硫化物沉淀而除去
固体是为了生成更难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为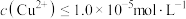 时,可认为
时,可认为 已沉淀完全,此时溶液中
已沉淀完全,此时溶液中 的浓度不小于
的浓度不小于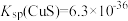 ]
](3)根据对滤液Ⅱ的操作作答:
①向滤液Ⅱ中加
 的目的是将
的目的是将 氧化成
氧化成 ,试从结构的角度解释
,试从结构的角度解释 易被氧化为
易被氧化为 的原因
的原因②调节滤液Ⅱ的
 ,
, 应控制在范围为
应控制在范围为③检验滤液Ⅲ中杂质金属离子是否除尽最合理的试剂是
(4)滤液Ⅲ溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到 固体,再加适量稀硫酸溶解又生成
固体,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是
您最近一年使用:0次

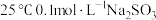 溶液加热到
溶液加热到 ,用传感器监测溶液
,用传感器监测溶液 水解平衡正向移动
水解平衡正向移动 和
和 溶液
溶液 混合溶液中滴加少量稀
混合溶液中滴加少量稀 溶液
溶液 和
和 的
的 大小
大小


