名校
解题方法
1 . 下列实验操作和实验现象所对应的实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 把分别盛有NaCl溶液和 胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体 胶体的两烧杯置于暗处,均用红色激光笔照射烧杯中的液体 | 观察到 胶体中有一条光亮的通路,NaCl溶液无明显现象 胶体中有一条光亮的通路,NaCl溶液无明显现象 | 丁达尔效应是胶体和溶液的本质区别 |
B | 向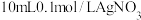 溶液中先滴入5滴0.1mol/LNaCl溶液,再滴入5滴0.1mol/L的KI溶液 溶液中先滴入5滴0.1mol/LNaCl溶液,再滴入5滴0.1mol/L的KI溶液 | 先产生白色沉淀,后产生黄色沉淀 | 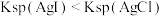 |
C | 向2支试管各加入 的草酸溶液,分别滴加 的草酸溶液,分别滴加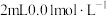 、 、 高锰酸钾溶液 高锰酸钾溶液 | 高锰酸钾溶液褪色并观察褪色时间 | 其他条件不变时,反应物浓度越大,反应速率越快 |
D | 取淀粉溶液于试管中,加入适量稀 后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制 后水浴加热5min,冷却后先加足量NaOH溶液,再加入适量新制 悬浊液并加热煮沸 悬浊液并加热煮沸 | 生成砖红色沉淀 | 淀粉已水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-08更新
|
135次组卷
|
2卷引用:江西省乐安县第二中学2023-2024学年高三上学期开学考试化学试题
2 .  时,向
时,向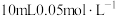 的
的 溶液中通入氨气,测得溶液中的
溶液中通入氨气,测得溶液中的 与
与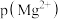 之间的变化曲线如图所示,[已知:
之间的变化曲线如图所示,[已知: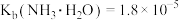 ,
,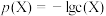 ,忽略反应过程中溶液体积的变化]。下列说法错误为是
,忽略反应过程中溶液体积的变化]。下列说法错误为是
 时,向
时,向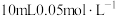 的
的 溶液中通入氨气,测得溶液中的
溶液中通入氨气,测得溶液中的 与
与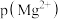 之间的变化曲线如图所示,[已知:
之间的变化曲线如图所示,[已知: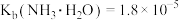 ,
,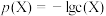 ,忽略反应过程中溶液体积的变化]。下列说法错误为是
,忽略反应过程中溶液体积的变化]。下列说法错误为是
A. 点溶液满足: 点溶液满足: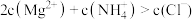 |
B.b点溶液中有 沉淀产生 沉淀产生 |
C. 点溶液中溶质有 点溶液中溶质有 、 、 、 、 |
D.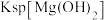 的数量级是 的数量级是 |
您最近一年使用:0次
解题方法
3 . 科学探究是化学学科核心素养之一,下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 相同条件下,分别测量 和 和 '醋酸溶液的导电性,前者的导电性强 '醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B |  溶液蒸干灼烧后得到红色固体 溶液蒸干灼烧后得到红色固体 | 固体成分是 |
| C | 向 和 和 混合溶液中,加入少量 混合溶液中,加入少量 的固体,溶液颜色无变化。 的固体,溶液颜色无变化。 | 改变离子浓度不会引起平衡移动 |
| D | 向盛有2mL0.1mol/L 溶液中滴加2滴0.1mol/L 溶液中滴加2滴0.1mol/L 溶液,得白色沉淀,再向其中加4滴0.1mol/L 溶液,得白色沉淀,再向其中加4滴0.1mol/L 溶液,沉淀转化为黄色 溶液,沉淀转化为黄色 |  的 的 比 比 的大 的大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
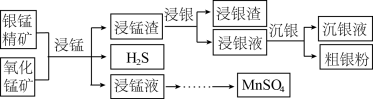
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.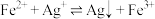 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: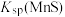
________ (填“>”或“<”)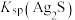 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________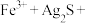 ________
________ ________
________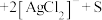
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 和
和________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
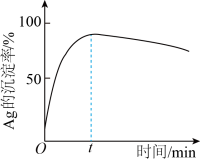
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
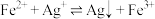 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: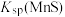
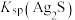 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
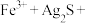 ________
________ ________
________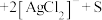
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
605次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题
5 . 一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
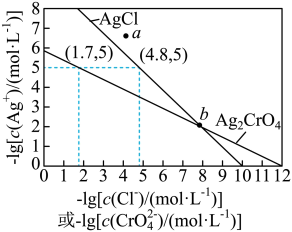
下列说法正确的是

下列说法正确的是
| A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀 |
B.b点时,c(Cl-)=c(CrO ),Ksp(AgCl)=Ksp(Ag2CrO4) ),Ksp(AgCl)=Ksp(Ag2CrO4) |
C.Ag2CrO4+2Cl- 2AgCl+CrO 2AgCl+CrO 的平衡常数K=107.9 的平衡常数K=107.9 |
| D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀 |
您最近一年使用:0次
2023-06-12更新
|
16247次组卷
|
33卷引用:江西省宜丰中学2022-2023学年高二下学期7月期末考试化学试题
江西省宜丰中学2022-2023学年高二下学期7月期末考试化学试题2023年高考全国乙卷化学真题(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国乙卷)(PPT+Word)(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南师范大学附属中学2024届高三摸底考试化学试题 (已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)河南省南阳市第一中学校2023-2024学年高三上学期第一次月考化学试题河南省南阳市南阳一中2023-2024学年高三上学期9月月考化学试题(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷重庆市南开中学校2023-2024学年高二上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)10-2023新东方高二上期中考化学(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省娄底市新化县2023-2024学年高二上学期期末考试化学试题北京市第一○一中学2023-2024学年高三下学期开学考试化学试题重庆市巫溪县中学校2023-2024学年高二上学期期末模拟考试化学试题河北i省石家庄市第二十四中学2023-2024学年高三上学期期末考试化学试题湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题天津市红桥区2024届高三一模化学试题河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学广西壮族自治区河池市普通高中2024届高三毕业班下学期模拟测试(二模)化学试题福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题北京市十一学校2024届高三下学期高考模拟练习化学试题
名校
解题方法
6 . 研究发现,在牙膏中添加氟化物能起到预防龋齿的作用,这是因为氟离子能与牙齿表面的釉质层{主要成分是羟基磷灰石[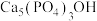 ]}发生反应生成氟磷灰石:
]}发生反应生成氟磷灰石: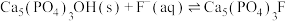
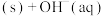 ,下列说法正确的是
,下列说法正确的是
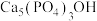 ]}发生反应生成氟磷灰石:
]}发生反应生成氟磷灰石: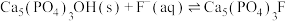
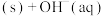 ,下列说法正确的是
,下列说法正确的是A.该反应的平衡常数表达式为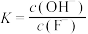 |
B.常温下,氟磷灰石的 比羟基磷灰石的大 比羟基磷灰石的大 |
| C.羟基磷灰石和氟磷灰石相比,羟基磷灰石更能够抵抗有机酸对牙齿的侵蚀 |
| D.羟基磷灰石的溶解速率等于氟磷灰石的生成速率时,反应达到平衡 |
您最近一年使用:0次
2023-06-09更新
|
363次组卷
|
4卷引用:江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题
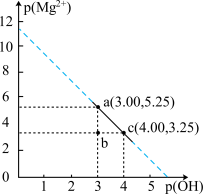
7 . 下图为 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是
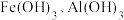 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是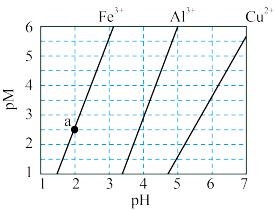
A.由 点可求得 点可求得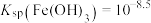 |
B. 时 时 的溶解度为 的溶解度为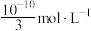 |
C.浓度均为 的 的 和 和 可通过分步沉淀进行分离 可通过分步沉淀进行分离 |
D.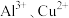 混合溶液中 混合溶液中 时二者不会同时沉淀 时二者不会同时沉淀 |
您最近一年使用:0次
2023-06-09更新
|
16931次组卷
|
33卷引用:江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷
江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷 2023年高考全国甲卷化学真题(已下线)T13-溶液中的离子平衡(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题16 水溶液中的离子平衡(已下线)2023年高考山东卷化学真题变式题(不定项选择题)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)海南省海南中学2023-2024学年高三上学期第0次月考化学试题河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)第32讲难溶电解质的溶解平衡(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析福建泉州培元中学2023-2024学年上学期高三10月月考化学试题(已下线)选择题11-16福建省福州第四中学2023-2024学年高三上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省淮北市2023-2024学年高三上学期1月调研化学试题(已下线)选择题11-15河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)天津市耀华中学2023-2024学年高二上学期1月期末化学试题天津市耀华中学2023-2024学年高二上学期期末学情调研化学试卷山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题
名校
8 . 常温下,三种金属硫化物XS、YS、ZS的饱和溶液中pM[pM= -lgc(M2+)]与pS[pS= -lgc(S2-)]的关系如图所示。已知:Ksp(XS) > Ksp(YS) > Ksp (ZS)。

| A.直线③代表ZS |
| B.Ksp (XS) =1 ×10-36 |
| C.向c点饱和溶液中加少量Na2S,c点向b点迁移 |
D.YS(s) +Z2+(aq)  ZS(s) +Y2+ (aq) K=1 ×108 ZS(s) +Y2+ (aq) K=1 ×108 |
您最近一年使用:0次
2023-06-06更新
|
185次组卷
|
3卷引用:江西省宜春市上高二中2023-2024学年高二下学期3月月考化学试题
9 . 地壳中各种物质存在各种转化,如金属铜的硫化物经生物氧化会转化为 ,流经
,流经 或
或 等含硫矿石又可以转化为
等含硫矿石又可以转化为 ,[已知
,[已知 ,
, ]。下列说法不正确的是
]。下列说法不正确的是
 ,流经
,流经 或
或 等含硫矿石又可以转化为
等含硫矿石又可以转化为 ,[已知
,[已知 ,
, ]。下列说法不正确的是
]。下列说法不正确的是
A.工业上可用 处理含有 处理含有 、 、 等金属硫化物的废水 等金属硫化物的废水 |
B.当溶液中有 和 和 共存时,溶液中 共存时,溶液中 |
C.基态 的价电子排布式为 的价电子排布式为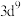 |
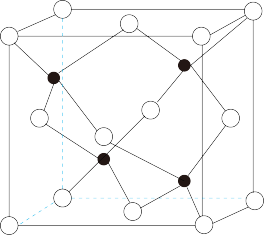
D. 的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个 的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个 |
您最近一年使用:0次
2023-05-21更新
|
144次组卷
|
3卷引用:江西省宜春市上高中学2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
10 . 光催化技术是指利用半导体材料在光照条件下激发产生强氧化性物质,将空气中的污染物分解为CO2、H2O等小分子,Bi2MoO6对可见光有较强的响应,在光催化领域具有稳定高效的催化效果,其制备方法如下:
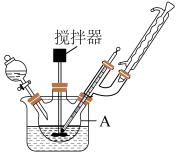
(一)微球状前驱体BiOI的制备
I.向反应仪器A中加入无水乙醇,并加入agBi(NO3)3·5H2O固体和足量KI固体,常温下搅拌30min至溶解完全。
Ⅱ.由分液漏斗滴加氨水调节溶液pH为7后,将反应装置放入油浴中,在80℃下回流3h。
Ⅲ.抽滤收集反应后的砖红色沉淀,经洗涤、干燥后研磨备用。
(二)Bi2MoO6的制备
Ⅳ.将上述制备得到的BiOI,足量Na2MoO4·2H2O和去离子水加入反应釜中,调节体系pH为7后,将反应釜密封好,于150℃下反应24h,自然冷却到室温,抽滤所得沉淀,经洗涤、干燥后得最终产物bg。
已知:①Bi(OH)3的Ksp为6.0×10-31;②Bi(NO3)3·5H2O和KI均可溶于乙醇;③Bi(NO3)3·5H2O的摩尔质量为485g·mol-1,Bi2MoO6的摩尔质量为610g·mol-1。
回答下列问题:
(1)制备BiOI的反应仪器A的名称是___________ 。
(2)I中不选择水作溶剂的主要原因是___________ 。
(3)Ⅱ中加入氨水后,发生反应的离子方程式为___________ 。
(4)Ⅱ中反应需在中性环境下进行。
①不可呈酸性的主要原因是___________ ,
②不可呈碱性的主要原因是___________ 。
(5)Ⅳ中反应的离子方程式为___________ 。
(6)Bi2MoO6的产率为___________ ×100%(用含a,b的代数式表示)。

(一)微球状前驱体BiOI的制备
I.向反应仪器A中加入无水乙醇,并加入agBi(NO3)3·5H2O固体和足量KI固体,常温下搅拌30min至溶解完全。
Ⅱ.由分液漏斗滴加氨水调节溶液pH为7后,将反应装置放入油浴中,在80℃下回流3h。
Ⅲ.抽滤收集反应后的砖红色沉淀,经洗涤、干燥后研磨备用。
(二)Bi2MoO6的制备
Ⅳ.将上述制备得到的BiOI,足量Na2MoO4·2H2O和去离子水加入反应釜中,调节体系pH为7后,将反应釜密封好,于150℃下反应24h,自然冷却到室温,抽滤所得沉淀,经洗涤、干燥后得最终产物bg。
已知:①Bi(OH)3的Ksp为6.0×10-31;②Bi(NO3)3·5H2O和KI均可溶于乙醇;③Bi(NO3)3·5H2O的摩尔质量为485g·mol-1,Bi2MoO6的摩尔质量为610g·mol-1。
回答下列问题:
(1)制备BiOI的反应仪器A的名称是
(2)I中不选择水作溶剂的主要原因是
(3)Ⅱ中加入氨水后,发生反应的离子方程式为
(4)Ⅱ中反应需在中性环境下进行。
①不可呈酸性的主要原因是
②不可呈碱性的主要原因是
(5)Ⅳ中反应的离子方程式为
(6)Bi2MoO6的产率为
您最近一年使用:0次
2023-05-17更新
|
156次组卷
|
2卷引用:江西省宜春市宜丰中学创新部2023-2024学年高三上学期期中考试化学试题



