1 . 化学是以实验为基础的学科,在科学实验中发现问题、分析问题、解决问题,体验实验的乐趣和科学探究的精神是学习化学的关键,下列实验操作和实验现象以及实验目的或结论有错误的是
| 选项 | 实验操作和实验现象 | 实验目的或结论 |
| A | 取少量待测液于试管中,先加入过量稀硝酸,无现象,再加入氯化钡溶液,有白色沉淀生成 | 该待测液中含有 或 或 |
| B | 向5mL 0.2mol/L  溶液中滴加5滴0.1mol/L NaOH溶液,生成白色沉淀,再滴加5滴0.1mol/L 溶液中滴加5滴0.1mol/L NaOH溶液,生成白色沉淀,再滴加5滴0.1mol/L  溶液,观察实验现象 溶液,观察实验现象 | 不能验证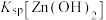 和 和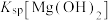 的相对大小 的相对大小 |
| C | 向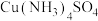 溶液中,加入过量锌粉,溶液由深蓝色变为无色 溶液中,加入过量锌粉,溶液由深蓝色变为无色 | 金属性:Zn>Cu |
| D | 向试管中依次加入苯、液溴、稀 溶液,将生成的气体先通入 溶液,将生成的气体先通入 ,再通入硝酸银溶液,产生白色沉淀 ,再通入硝酸银溶液,产生白色沉淀 | 苯与液溴发生取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下列实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 在对甲基苯酚中滴少量酸性 溶液 溶液 | 证明羟基具有还原性 |
| B | 向紫色石蕊溶液中通入 至过量 至过量 | 验证 具有漂白性 具有漂白性 |
| C | 在医用酒精中加小块钠 | 证明乙醇会与钠反应 |
| D | 在AgCl浊液、AgI浊液中分别加入过量的同浓度浓氨水(白色沉淀溶解,黄色沉淀几乎不溶解) | 证明:Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
134次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
3 . 25℃时,难溶物M(OH)3和R(OH)2形成的饱和液中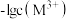 或
或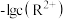 与pH的变化关系如图所示。设难溶电解质的溶解度单位为mol·L-1,下列说法正确的是
与pH的变化关系如图所示。设难溶电解质的溶解度单位为mol·L-1,下列说法正确的是
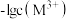 或
或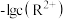 与pH的变化关系如图所示。设难溶电解质的溶解度单位为mol·L-1,下列说法正确的是
与pH的变化关系如图所示。设难溶电解质的溶解度单位为mol·L-1,下列说法正确的是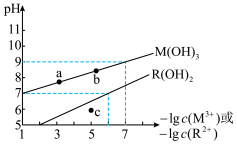
| A.25℃时,c点时的R(OH)2溶液为饱和溶液 |
| B.向M(OH)3饱和溶液中加入盐酸可使a点变到b点 |
C.pH=8时,M(OH)3的溶解度为 |
| D.浓度均为0.1mol/L的M3+和R2+,调节pH,当M(OH)3开始沉淀时,有R(OH)2沉淀生成 |
您最近一年使用:0次
2024-05-15更新
|
52次组卷
|
2卷引用:江西省九江市同文中学2023-2024学年高三下学期期中考试化学试题
4 . 络合反应的平衡常数称为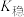 ,
,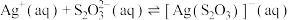
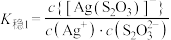 ,
,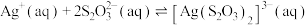
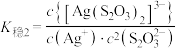 ,
, 。常温下,在含
。常温下,在含 (
( 代表
代表 )和
)和 的混合溶液中滴加
的混合溶液中滴加 溶液,溶液中
溶液,溶液中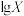 [
[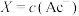 、
、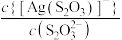 、
、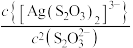 与
与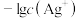 的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
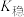 ,
,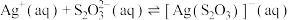
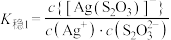 ,
,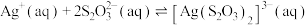
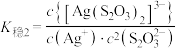 ,
, 。常温下,在含
。常温下,在含 (
( 代表
代表 )和
)和 的混合溶液中滴加
的混合溶液中滴加 溶液,溶液中
溶液,溶液中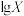 [
[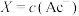 、
、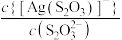 、
、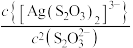 与
与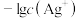 的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
A. 代表 代表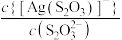 与 与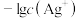 的关系 的关系 |
B.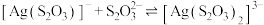 的 的 |
C.饱和AgAc溶液中 |
D.M点对应坐标为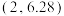 |
您最近一年使用:0次
2024-05-11更新
|
118次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
5 . 下列实验方案能达到探究目的的是
| 选项 | 实验方案 | 探究目的 |
| A | 将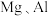 金属棒用导线及小灯泡连接,同时插入 金属棒用导线及小灯泡连接,同时插入 的 的 溶液中 溶液中 | 比较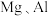 的金属性 的金属性 |
| B | 向 溶液中通入足量的 溶液中通入足量的 | 比较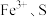 的氧化性 的氧化性 |
| C | 向 溶液中加入过量 溶液中加入过量 溶液,再加入 溶液,再加入 溶液 溶液 | 比较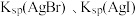 的大小 的大小 |
| D | 向酸性 溶液中通入某无色气体 溶液中通入某无色气体 | 验证该气体为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 化学与日常生活紧密相关,下列项目与所述化学知识的描述,有误的是
选项 | 项目 | 化学知识 |
A | 橡胶进行硫化 | 形成交联结构,增强橡胶的强度、弹性、韧性等 |
B | 酒精可用于消毒 | 酒精具有强氧化性 |
C | 氯化钙用作融雪剂 | 氯化钙溶解放热,加速冰雪的融化,且盐水凝固点比水更低 |
D | 含氟牙膏用于预防龋齿 | 牙膏中的氟化物与牙齿发生反应后,产物更难溶于水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 室温下,下列实验方案能达到探究目的的是
实验方案 | 探究目的 | |
A | 将 | 温度升高, |
B | 向 | 除去 |
C | 取两份等量的新制氯水,分别滴加 | 证明氯气与水的反应是可逆反应 |
D | 向同浓度 | 比较 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-10更新
|
107次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期1月期末化学试题
8 . 处理废旧电池[主要含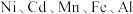 、铼
、铼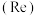 ]的流程如下:
]的流程如下:
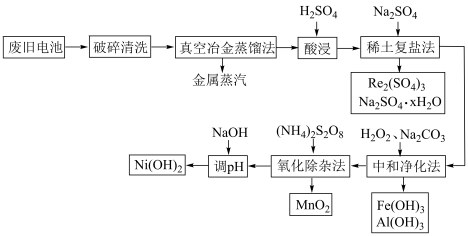
下列说法正确的是
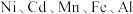 、铼
、铼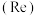 ]的流程如下:
]的流程如下:
下列说法正确的是
A.金属 的沸点高于其他金属 的沸点高于其他金属 |
B.生成复盐的离子方程式为 |
C.在实际中和净化过程中,需要的 与 与 的物质的量之比应为 的物质的量之比应为 |
D. 中, 中, 为 为 价,其中含有2个过氧键 价,其中含有2个过氧键 |
您最近一年使用:0次
2023-12-09更新
|
262次组卷
|
2卷引用:江西省上饶市广丰中学2023-2024学年高二上学期12月考试化学试卷
名校
解题方法
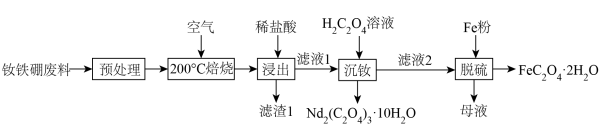
9 . 钕铁硼废料是一种具有较高经济价值的废弃物,主要成分为稀土元素钕(Nd)、Fe、B.一种采用分步沉淀从钕铁硼油泥中回收Nd2(C2O4)3·10H2O和FeC2O4·2H2O的工艺流程如图:
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择___________ (填化学式)溶液。
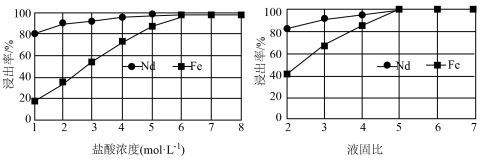
(2)“滤渣1”的主要成分是___________ (填名称)。“浸出”时,盐酸浓度和液固比对钕、铁的浸出率影响如图所示,则浸出过程的最佳条件是___________ 。___________ 。
(4)“沉铁”时,加入铁粉的作用是___________ 。
(5)FeC2O4·2H2O晶体结构片段如图所示。___________ ;碳原子采用___________ 杂化。现测定草酸亚铁晶体纯度。准确称取Wg样品于锥形瓶,加入适量的稀硫酸,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液bmL。滴定反应: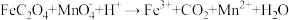 (未配平)。该样品纯度为
(未配平)。该样品纯度为___________ %。
②H2CO4易与Fe3+形成多种配合物离子,易与Fe2+形成FeC2O4·2H2O沉淀。
回答下列问题:
(1)“预处理”是洗去钕铁硼表面的油污,可选择
(2)“滤渣1”的主要成分是
(4)“沉铁”时,加入铁粉的作用是
(5)FeC2O4·2H2O晶体结构片段如图所示。
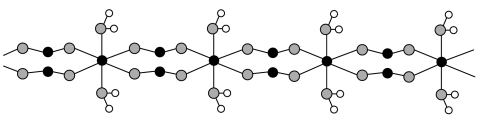
 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
2023-11-01更新
|
1024次组卷
|
5卷引用:2024届江西省南昌市第十九中学高三下学期模拟预测化学试题
名校
解题方法
10 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
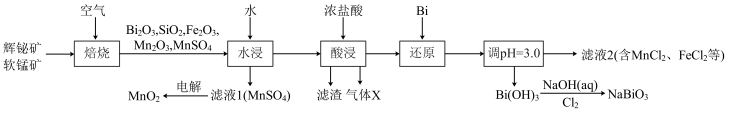
已知:①金属活动性: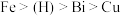 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
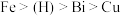 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题

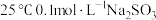 溶液加热到
溶液加热到 ,用传感器监测溶液
,用传感器监测溶液 变化
变化 水解平衡正向移动
水解平衡正向移动 和
和 的混合物中加入足量的稀硝酸,然后过滤、洗涤、干燥
的混合物中加入足量的稀硝酸,然后过滤、洗涤、干燥 溶液
溶液 和
和 混合溶液中滴加少量稀
混合溶液中滴加少量稀 和
和 的
的 大小
大小

