名校
1 . 已知常温下水溶液中 、
、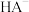 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中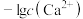 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
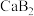 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、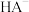 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中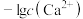 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
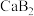 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数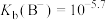 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1875次组卷
|
12卷引用:江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题
江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
名校
2 . 龋齿是牙釉质溶解后病菌趁虚而入的结果。已知牙釉质的主要成分是羟磷灰石,口腔中存在如下平衡:
①羟磷灰石Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+OH(aq)
(aq)+OH(aq)
②氟磷灰石的化学式是Ca5(PO4)3F,Ca5(PO4)3F(s) 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+F(aq),
(aq)+F(aq),
氟磷灰石的溶解度比羟磷灰石小。下列有关说法中不正确的是
①羟磷灰石Ca5(PO4)3OH(s)
 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+OH(aq)
(aq)+OH(aq) ②氟磷灰石的化学式是Ca5(PO4)3F,Ca5(PO4)3F(s)
 5Ca2+(aq)+3PO
5Ca2+(aq)+3PO (aq)+F(aq),
(aq)+F(aq),氟磷灰石的溶解度比羟磷灰石小。下列有关说法中不正确的是
| A.一定条件下,羟磷灰石可以转化为氟磷灰石 |
| B.氟磷灰石可阻止龋齿的发生 |
| C.使用添加NaF等氟化物的牙膏可以防治龋齿 |
| D.当糖附着在牙齿上发酵时,会产生H+,所以多吃糖可以防治龋齿 |
您最近一年使用:0次
2023-03-27更新
|
286次组卷
|
3卷引用:江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题
江西省丰城中学2022-2023学年高一下学期4月期中考试化学试题广东省深圳市龙华区2022-2023学年高二上学期期末质量检测化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
3 . 下列操作、现象和结论都正确的是
| 选项 | 操作与现象 | 结论 |
| A | 在Cu和稀硫酸中滴加 溶液,铜继续溶解 溶液,铜继续溶解 |  作该反应的催化剂 作该反应的催化剂 |
| B | 电解含 、 、 的硝酸盐溶液,优先析出红色固体 的硝酸盐溶液,优先析出红色固体 | 氧化性: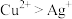 |
| C | 在 浊液中滴加 浊液中滴加 溶液生成粉红色沉淀 溶液生成粉红色沉淀 | 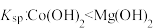 |
| D | 测定浓度相同的 、NaCN溶液pH,后者较大 、NaCN溶液pH,后者较大 | 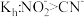 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 下列实验过程可以达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定中和热 | 将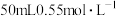 的NaOH溶液一次性迅速倒入盛 的NaOH溶液一次性迅速倒入盛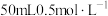 盐酸的烧杯中 盐酸的烧杯中 |
| B | 证明炭可与浓 反应生成 反应生成 | 向浓 中插入红热的炭,产生红棕色气体 中插入红热的炭,产生红棕色气体 |
| C | 证明AgCl的溶解度大于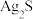 | 向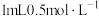 的 的 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液中滴加几滴NaCl溶液,产生白色沉淀,再滴加几滴 溶液产生黑色沉淀 溶液产生黑色沉淀 |
| D | 制取氨气并干燥 | 加热氯化铵和氢氧化钙的混合物,将产生的气体通过装有无水氯化钙的干燥管 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-30更新
|
270次组卷
|
2卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
名校
解题方法
5 . 水溶液中的离子反应与平衡在工农业生产和日常生活中有着广泛的应用,下列说法错误的是
| A.明矾净水的原理与Al3+的水解有关 |
| B.用醋酸浸泡可以除去锅炉水垢中的CaSO4 |
| C.误服BaCl2或BaCO3后可用Na2SO4溶液解毒 |
D.长期使用 化肥的土壤酸性会增强 化肥的土壤酸性会增强 |
您最近一年使用:0次
2022-11-26更新
|
297次组卷
|
2卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
6 . 向10mL浓度均为0.1mol·L-1的FeSO4和ZnSO4的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水(K b=1.8×10-5)体积关系如图所示,测得M、N点溶液pH分别为8.04、8.95。
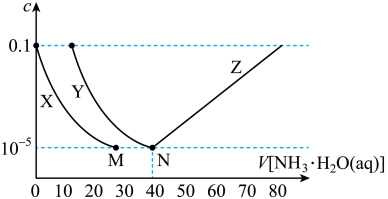
已知:i.Zn2++4NH3 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06
ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是

已知:i.Zn2++4NH3
 [Zn(NH3)4]2+
[Zn(NH3)4]2+ =109.06
=109.06ii.Ksp[Zn(OH)2]<Ksp[Fe(OH)2]。
下列说法错误的是
| A.曲线X表示Zn2+ |
| B.Ksp[Fe(OH)2]=10-15.1 |
| C.N点锌元素的主要存在形式是[Zn(NH3)4]2+ |
D.Zn(OH)2+4NH3 [Zn(NH3)4]2++2OH- K=10-7.86 [Zn(NH3)4]2++2OH- K=10-7.86 |
您最近一年使用:0次
2022-11-18更新
|
1216次组卷
|
5卷引用:江西省宜春市九校2023届高三下学期第二次联考理科综合化学试题
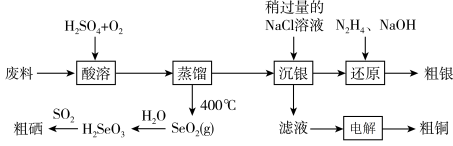
7 . 科学家开发出的新型太阳能铜铟镓二硒(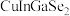 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含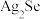 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为___________ 。
(2)下列事实能说明硫的非金属性比硒的强的是___________ (填标号)。
A.溶解度: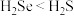
B.沸点: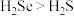
C.酸性: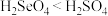
(3)“酸溶”时,能提高反应速率的措施有___________ (答1条即可)。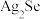 、
、 和
和 反应的化学方程式为
反应的化学方程式为___________ 。
(4)“电解”时,阳极生成的气体为___________ (填化学式),电解结束后,电解液的pH___________ (填“增大”、“减小”或“不变”)。
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下___________ LSO2参与反应。
(6)“沉银”时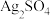 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
___________ 。[已知:常温下,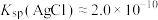 ,
,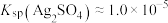 ]
]
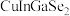 )电池,光电转化率达到25%。某小组以硒化银半导体废料(含
)电池,光电转化率达到25%。某小组以硒化银半导体废料(含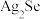 、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
、Cu)为原料提取硒、铜、银,进而制备上述太阳能电池材料。请回答下列问题:
(1)NaOH的电子式为
(2)下列事实能说明硫的非金属性比硒的强的是
A.溶解度:
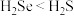
B.沸点:
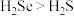
C.酸性:
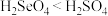
(3)“酸溶”时,能提高反应速率的措施有
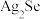 、
、 和
和 反应的化学方程式为
反应的化学方程式为(4)“电解”时,阳极生成的气体为
(5)在上述流程中,H2SeO3转化为Se的过程中,当生成23.7gSe时,理论上有标准状况下
(6)“沉银”时
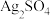 转化成AgCl,,该反应的平衡常数
转化成AgCl,,该反应的平衡常数
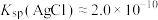 ,
,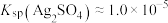 ]
]
您最近一年使用:0次
8 . 按要求完成下列各空:
(1)25℃时,pH=2的盐酸 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则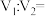
_______ 。
(2)25℃时,在等体积的①pH=1的 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是_______ 。
(3)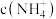 相等的①
相等的① 溶液、②
溶液、②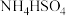 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为_______ 。(填写序号)
(4)向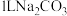 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中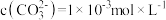 时,此时溶液中
时,此时溶液中
_______  。[已知
。[已知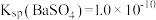 ,
,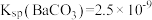 ]
]
(1)25℃时,pH=2的盐酸
 L与pH=10的NaOH溶液
L与pH=10的NaOH溶液 L混合,所得溶液pH=4,则
L混合,所得溶液pH=4,则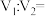
(2)25℃时,在等体积的①pH=1的
 溶液、②
溶液、② 的
的 溶液、③pH=10的
溶液、③pH=10的 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是(3)
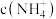 相等的①
相等的① 溶液、②
溶液、②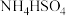 溶液、③
溶液、③ 溶液、④
溶液、④ 溶液,其物质的量浓度由大到小的顺序为
溶液,其物质的量浓度由大到小的顺序为(4)向
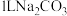 溶液中加入足量
溶液中加入足量 固体,当溶液中
固体,当溶液中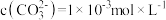 时,此时溶液中
时,此时溶液中
 。[已知
。[已知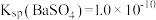 ,
,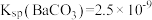 ]
]
您最近一年使用:0次
解题方法
9 . 草酸亚铁晶体 FeC2O4·2H2O (其相对分子质量为180)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如图:


(1)仪器A的名称是_______ 。
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)_______ 。
(3)“洗涤”步骤的操作方法_______ 。
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量稀硫酸溶解,用0.05000mol·L-1酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。计算样品中FeC2O4·2H2O的纯度_______ (保留四位有效数字)
(5)实验中烘干后得到的草酸亚铁晶体FeC2O4·2H2O,称取5.40 g该样品在氩气气氛中进行热重法分析,得到剩余固体的质量随温度变化的曲线如图所示:

①上述FeC2O4·2H2O在氩气气氛进行热重法分析的原因是_______ 。
②分析图中数据,根据信息写出B对应的产物为_______ (填化学式)。
③600℃时剩余固体只有一种铁的氧化物, 且生成两种物质的量相等的气体。试写出B至C进程中所发生的化学反应方程式_______ 。


(1)仪器A的名称是
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)
(3)“洗涤”步骤的操作方法
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量稀硫酸溶解,用0.05000mol·L-1酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。计算样品中FeC2O4·2H2O的纯度
(5)实验中烘干后得到的草酸亚铁晶体FeC2O4·2H2O,称取5.40 g该样品在氩气气氛中进行热重法分析,得到剩余固体的质量随温度变化的曲线如图所示:

①上述FeC2O4·2H2O在氩气气氛进行热重法分析的原因是
②分析图中数据,根据信息写出B对应的产物为
③600℃时剩余固体只有一种铁的氧化物, 且生成两种物质的量相等的气体。试写出B至C进程中所发生的化学反应方程式
您最近一年使用:0次
名校
10 . 以碳酸锰铜矿(主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO等杂质)为原料制备硫酸锰的一种工艺流程如下:
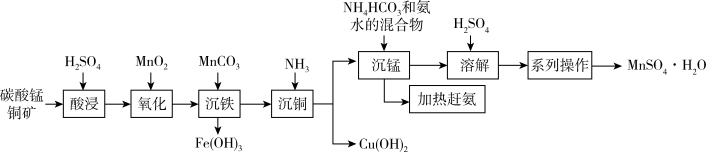
(1)“氧化”时,反应的离子方程式为_______ 。可用一种试剂检验氧化后的溶液中是否含有Fe2+,该试剂为_______ (写化学式)。
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_______ 。
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为_______ 。[已知:常温下,Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=2.1×10-13,离子浓度小于或等于10-5mol/L可视为沉淀完全]
(4)本工艺中可循环使用的物质是_______ 。
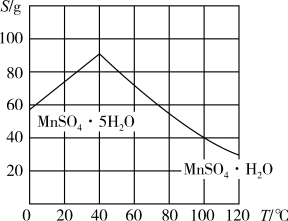
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:_______ 、_______ ,酒精洗涤,低温干燥。

(1)“氧化”时,反应的离子方程式为
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为
(3)“沉铜"时,若滤液中c(Mn2+)=0.21mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为
(4)本工艺中可循环使用的物质是
(5)结合图象,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:

您最近一年使用:0次
2022-04-13更新
|
677次组卷
|
6卷引用:江西省九江市2022届第二次高考模拟统一考试理综化学试题
江西省九江市2022届第二次高考模拟统一考试理综化学试题江西省安义中学2022-2023学年高三上学期中考试化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题



