解题方法
1 . 化学与生产生活联系紧密,下列有关说法正确的是
| A.热的纯碱溶液可用于洗涤煤油、柴油等矿物油污 |
| B.水垢中的CaSO4,可先转化为CaCO3 ,再用酸除去 |
| C.胃舒平主要成分[(Al(OH)3]和食醋同时服用可增强药效 |
| D.可溶性的铝盐可处理水中的悬浮物并能对水消毒杀菌 |
您最近一年使用:0次
名校
解题方法
2 . 一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
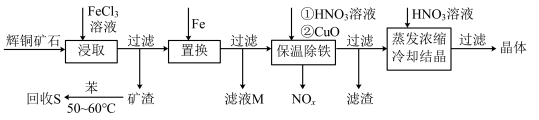
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___ 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___ 。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___ 。
(4)向滤液M中加入(或通入)___ (填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_ 。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___ mol。


(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是
(4)向滤液M中加入(或通入)
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S

您最近一年使用:0次
2019-12-19更新
|
1285次组卷
|
10卷引用:江西省南昌市第二中学2020届高三5月模拟理综化学试题
江西省南昌市第二中学2020届高三5月模拟理综化学试题江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题江西省新余市第四中学2021届高三化学上学期第四次考试试题广东省六校联盟(深圳实验,广州二中,珠海一中,惠州一中,东莞中学,中山纪中)2020届高三第二次联考理综化学试题2020届高三《新题速递·化学》1月第01期(考点11-13)宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题2022届陕西省宝鸡市陈仓区高考模拟检测(二)理综化学试题天津市河东区2022-2023学年高三上学期期中检测化学试题(已下线)第三章 金属及其化合物 第15练 金属材料 金属冶炼
3 . 已知在25 ℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| D.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
您最近一年使用:0次
2019-12-18更新
|
268次组卷
|
10卷引用:2015-2016学年江西省上高二中高二上12月月考化学试卷
2015-2016学年江西省上高二中高二上12月月考化学试卷(已下线)2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年山西省大同一中高二上学期期中考试化学试卷2015-2016学年内蒙古赤峰市宁城县高二上学期期末考试化学试卷2016-2017学年山西省怀仁一中高二上月考四化学卷宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题湖南省邵东县第一中学2019-2020学年高二上学期第三次月考化学试题内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第三次月考化学试题
4 . 硫化镉(CdS)是一种难溶于水的黄色颜料,其溶解为吸热过程,在水中的沉淀溶解平衡曲线如图。下列说法错误的是( )


| A.图中T1<T2 |
| B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)=Ksp(p) |
| C.温度降低时,q点的饱和溶液会有固体析出 |
| D.向P点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动 |
您最近一年使用:0次
2019-12-17更新
|
236次组卷
|
2卷引用:江西省南昌市第十中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
5 . 已知AgCl的沉淀溶解平衡为AgCl(s)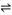 Ag+(aq)+Cl−(aq),下列说法中错误的是( )
Ag+(aq)+Cl−(aq),下列说法中错误的是( )
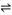 Ag+(aq)+Cl−(aq),下列说法中错误的是( )
Ag+(aq)+Cl−(aq),下列说法中错误的是( )| A.向AgCl悬浊液中加少量水,c(Ag+)一定减小 |
B.AgCl饱和溶液中c(Ag+)=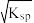 mol/L mol/L |
| C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失 |
| D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr |
您最近一年使用:0次
2019-12-17更新
|
91次组卷
|
2卷引用:江西省南昌市第十中学2019-2020学年高二上学期第二次月考化学试题
名校
解题方法
6 . 下列说法正确的是( )
| A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大 |
B.已知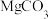 的 的 ,则所有含有固体MgCO3的溶液中,都有 ,则所有含有固体MgCO3的溶液中,都有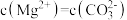 ,且 ,且 |
C.可通过比较 和 和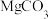 的Ksp的大小比较它们的溶解性 的Ksp的大小比较它们的溶解性 |
D.25 ℃时 ,故新生成的 AgCl可转化为AgI ,故新生成的 AgCl可转化为AgI |
您最近一年使用:0次
2019-12-16更新
|
557次组卷
|
2卷引用:步步为赢 高二化学寒假作业:作业十一 难溶电解质的溶解平衡
2011·江苏南通·一模
名校
解题方法
7 . 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如表。
表1.几种砷酸盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________ mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=________ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol·L-1,c(AsO43-)最大是______ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:_______________________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为__________ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_______________________ 。
表1.几种砷酸盐的Ksp
| 难溶物 | Ksp | |
| Ca3(AsO4)2 | 6.8×10-19 | |
| AlAsO4 | 1.6×10-16 | |
| FeAsO4 | 5.7×10-21 | |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g·L-1 | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
回答下列问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:
Ksp[Ca3(AsO4)2]=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3为弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4为弱酸),写出该反应的离子方程式:
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为
您最近一年使用:0次
2019-12-03更新
|
183次组卷
|
7卷引用:2011届江苏省南通市高三第一次调研测试化学试卷
(已下线)2011届江苏省南通市高三第一次调研测试化学试卷(已下线)2012届江苏省阜宁、大丰、栟茶高级中学高三第二次调研联考化学试卷(已下线)2013届江苏省泗阳致远中学高三实验班第一次模拟考试化学试卷(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》安徽省太和第一中学2020-2021学年高二上学期期中考试化学(普通班)试题江西赣州市2022~2023学年高二上学期期末考试化学试题河南省中原名校2021-2022学年高二上学期期末联考化学试题
13-14高二·全国·课时练习
名校
8 . 已知25 ℃时一些难溶物质的溶度积常数如下,根据表中数据,判断下列化学方程式不正确的是( )
化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
| A.2AgCl+Na2S===2NaCl+Ag2S |
B.MgCO3+H2O Mg(OH)2+CO2↑ Mg(OH)2+CO2↑ |
| C.ZnS+2H2O===Zn(OH)2↓+H2S↑ |
| D.Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O |
您最近一年使用:0次
2019-12-03更新
|
211次组卷
|
6卷引用:2014-2015江西省德镇市高二上学期期末化学试卷
2014-2015江西省德镇市高二上学期期末化学试卷(已下线)【南昌新东方】江西省九江一中2014-2015学年高二上学期期中化学试卷(已下线)2014年高中化学人教版选修四第三章 水溶液中的离子平衡练习卷2016-2017学年山西省大同一中高二12月月考化学试卷【全国百强校】吉林省实验中学2018-2019学年高二上学期期末考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》
9 . 根据如表实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现 | 结论 |
A | 常温下,将FeCl3溶液加入Mg(OH)2悬浊液中,沉淀由白色变为红褐色 | 常温下,Ksp[Fe(OH)3]> Ksp[Mg(OH)2] |
B | 向某溶液中滴加稀硝酸酸化的BaCl2溶液,溶液中产生白色沉淀 | 原溶液中一定含有SO42﹣ |
C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
D | 向含酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-27更新
|
370次组卷
|
2卷引用:江西省赣州市赣县中学北校区2019-2020学年高二上学期12月月考化学试题
名校
解题方法
10 . 下列实验操作、实验现象和实验结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| B | 向KMnO4酸性溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
| C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3·H2O能大量共存 |
| D | 向10 mL 0.1 mol·L-1 Na2S溶液中滴入2 mL 0.1 mol·L-1 ZnSO4溶液,再加入2 mL 0.1 mol·L-1 CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-22更新
|
409次组卷
|
8卷引用:江西省南昌市2017届高三二模测试卷理综化学试题



