名校
1 . 化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关该反应的推理
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确 的是
 CuS(s)+Mn2+(aq)。下列有关该反应的推理
CuS(s)+Mn2+(aq)。下列有关该反应的推理| A.MnS的溶解度比CuS的溶解度大 |
| B.该反应达到平衡时,c(Cu2+)=c(Mn2+) |
| C.向上述平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应平衡常数K=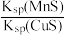 |
您最近一年使用:0次
2020-01-23更新
|
184次组卷
|
9卷引用:江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中联考(自主班)化学试题
江西省上饶市“山江湖”协作体2019-2020学年高二上学期期中联考(自主班)化学试题2015届湖南省岳阳市高三教学质量检测化学试卷高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡河北省唐山一中2017-2018学年高二上学期12月月考化学试题吉林省白城市第一中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】湖北省黄冈市黄冈中学2018-2019高二上学期期中模考化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二下学期开学考试化学试题河北省衡水市深州市中学2020届高三第一次月考化学试题(已下线)第28讲 难溶电解质的溶解平衡 (精练)-2021年高考化学一轮复习讲练测
2 . 下列说法正确的是
| A.S(g)+O2(g)=SO2 (g)可用该反应的ΔH表示燃烧热 |
| B.通过直接蒸发MgCl2溶液的方法获取无水氯化镁固体 |
| C.除去CuCl2溶液中的Fe3+,选用氢氧化钠溶液作沉淀剂 |
| D.一定温度下,反应 MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0、ΔS>0 |
您最近一年使用:0次
2020-01-20更新
|
141次组卷
|
2卷引用:安徽省合肥市六校2019-2020学年高二上学期期末考试化学(理)试题
名校
3 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
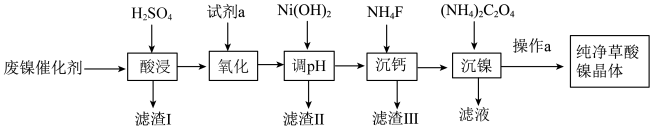
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:______________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:__________ ,当Ca2+沉淀完全时,溶液中 c(F-)>________ mol·L-1(写出计算式即可)。
(5)操作a的内容是____________________ 。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
(5)操作a的内容是
您最近一年使用:0次
名校
4 . 以下实验操作方法以及结论错误的是( )
①用燃烧的方法鉴别乙醇、四氯化碳、苯
②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去
③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸、氢氧化钠、酸碱指示剂。
④向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则 Ksp(BaCO3)﹤Ksp(BaSO4)
⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离
⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液
⑦用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。
①用燃烧的方法鉴别乙醇、四氯化碳、苯
②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去
③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸、氢氧化钠、酸碱指示剂。
④向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则 Ksp(BaCO3)﹤Ksp(BaSO4)
⑤油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离
⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液
⑦用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。
| A.②③④⑤⑥ | B.①②⑥⑦ | C.③④⑤⑥ | D.②④⑤⑥ |
您最近一年使用:0次
名校
解题方法
5 . 下列图示与对应的叙述相符的是( )


| A.图1中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性 |
| B.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- |
C.图3表示在N2(g)+3H2(g)  2NH3(g)达到平衡后,减小NH3浓度时速率的变化 2NH3(g)达到平衡后,减小NH3浓度时速率的变化 |
| D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+) |
您最近一年使用:0次
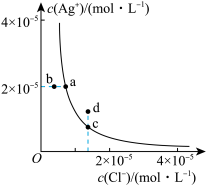
6 . 某温度时,AgCl(s) Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
 Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是( )
| A.加入AgNO3可以使溶液由c点变到d点 |
| B.加入NaCl固体则AgCl的溶解度减小,Ksp也减小 |
| C.蒸发溶液可以实现b点到a点的转化 |
| D.图中d点对应的是过饱和溶液 |
您最近一年使用:0次
2020-01-16更新
|
261次组卷
|
4卷引用:江西省余干县新时代学校2020-2021学年高二上学期阶段测试(二)化学试题
12-13高二下·江西抚州·期末
名校
7 . 如表为有关化合物的pKsp,pKsp=-lgKsp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY,则沉淀转化为AgY;③向②中加入NaZ,沉淀又转化为AgZ。则表中a、b、c的大小关系为
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
| A.a>b>c | B.a<b<c | C.c<a<b | D.a+b=c |
您最近一年使用:0次
2020-01-16更新
|
518次组卷
|
7卷引用:2012-2013学年江西省抚州市高二下学期期末考试化学试卷
(已下线)2012-2013学年江西省抚州市高二下学期期末考试化学试卷江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期末考试化学试题(已下线)第5讲 难溶电解质的溶解平衡
名校
8 . 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
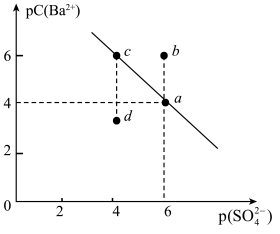

| A.加入BaCl2可以使溶液由c点变到a点 |
| B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4) |
| C.d点表示的是该温度下BaSO4的不饱和溶液 |
| D.该温度下,Ksp(BaSO4)=1.0×10-24 |
您最近一年使用:0次
2020-01-15更新
|
442次组卷
|
14卷引用:江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题
江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题江西省横峰中学2017-2018学年高二上学期第三次月考化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期期末考试化学试题江西省赣县第三中学2020-2021学年高二上学期12月月考化学试题2014-2015湖北省襄阳市五中高二3月月考化学试卷2015-2016学年河南省南阳一中高二下期末模拟化学试卷河南省驻马店市2016-2017学年高二下学期期末考试化学试题湖北省荆门市2016-2017学年高二下学期期末质量检测化学试题四川省石室中学2017-2018学年高二上学期半期考试化学试题【全国百强校】山西省长治市第二中学2018-2019学年高二上学期第二次月考(期中)化学试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——沉淀溶解平衡的曲线分析(已下线)题型27 沉淀溶解平衡常数及其应用图象
名校
解题方法
9 . 以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为____________ (填化学式)而除去.
(2)①中加入的试剂应该选择________ 为宜,其原因是__________ .
(3)②中除去Fe3+所发生的总反应的离子方程式为______________________________ .
(4)下列与方案③相关的叙述中,正确的是______ (填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为
(2)①中加入的试剂应该选择
(3)②中除去Fe3+所发生的总反应的离子方程式为
(4)下列与方案③相关的叙述中,正确的是
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
您最近一年使用:0次
10 . 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++ +H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++
+H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++ =CuCO3↓
=CuCO3↓
(2)CuSO4+Na2S主要:Cu2++S2-=CuS↓ 次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
(1)CuSO4+Na2CO3主要:Cu2++
 +H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++
+H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++ =CuCO3↓
=CuCO3↓(2)CuSO4+Na2S主要:Cu2++S2-=CuS↓ 次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
| A.Cu(OH)2>CuCO3>CuS | B.CuS>Cu(OH)2>CuCO3 |
| C.CuS<Cu(OH)2<CuCO3 | D.Cu(OH)2<CuCO3<CuS |
您最近一年使用:0次
2020-01-12更新
|
223次组卷
|
32卷引用:2011届江西省上高二中高三上学期第三次月考化学试卷
(已下线)2011届江西省上高二中高三上学期第三次月考化学试卷2016-2017学年江西省南昌二中高二上第二次考试化学卷江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题(已下线)2010年浙江省温州二中高二第二学期期中考试化学试题(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2010—2011学年湖北省蒲圻高中高二上学期期末统考化学试卷(已下线)2011-2012学年河北省魏县一中高二上学期期中考试化学试卷(已下线)2011-2012学年河北唐山市第一中学高二年级调研考试化学试卷(已下线)2011-2012学年河北广平县第一中学高二第二次调研考试理科化学试题(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(已下线)2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(已下线)2014年高考化学一轮复习课后规范训练8-4练习卷2014-2015学年湖北省长阳县第一高级中学高二上学期期中化学试卷2015届上海理工大学附中高三上学期月考化学试卷2014-2015山西省山大附中高二12月月考化学试卷2014-2015福建省三明一中高二上学期第二次月考化学试卷2016届安徽省巢湖市无为一中高三上学期第一次月考化学试卷内蒙古赤峰二中2017-2018学年高二上学期第二次月考化学试题内蒙古赤峰二中2017-2018学年高二上学期第一次月考化学试题广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题(已下线)2018年9月30日《每日一题》人教选修4每周一测【全国百强校】河北省石家庄市第二中学2018-2019学年高二第一学期12月月考化学试题2019年广东省汕头市高三第一次模拟考试化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题(已下线)上海市奉贤区2014届高三1月调研(期末)测试化学试题新疆伊犁奎屯市第一高级中学2020-2021学年高二上学期期末考试化学试题广东省揭阳普宁二中2021届上学期高三第二次月考化学试题上海市实验学校2021-2022学年高三下学期4月月考化学试题上海市川沙中学2021-2022学年高三下学期5月月考化学试题河北省行唐启明中学2022-2023学年高二上学期期末考试化学试题



