1 . 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++ +H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++
+H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++ =CuCO3↓
=CuCO3↓
(2)CuSO4+Na2S主要:Cu2++S2-=CuS↓ 次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
(1)CuSO4+Na2CO3主要:Cu2++
 +H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++
+H2O=Cu(OH)2↓+CO2↑ 次要:Cu2++ =CuCO3↓
=CuCO3↓(2)CuSO4+Na2S主要:Cu2++S2-=CuS↓ 次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
| A.Cu(OH)2>CuCO3>CuS | B.CuS>Cu(OH)2>CuCO3 |
| C.CuS<Cu(OH)2<CuCO3 | D.Cu(OH)2<CuCO3<CuS |
您最近一年使用:0次
2020-01-12更新
|
222次组卷
|
32卷引用:2011届江西省上高二中高三上学期第三次月考化学试卷
(已下线)2011届江西省上高二中高三上学期第三次月考化学试卷2016-2017学年江西省南昌二中高二上第二次考试化学卷江西省上高县第二中学2017-2018学年高二上学期期末考试化学试题(已下线)2010年浙江省温州二中高二第二学期期中考试化学试题(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2010—2011学年湖北省蒲圻高中高二上学期期末统考化学试卷(已下线)2011-2012学年河北省魏县一中高二上学期期中考试化学试卷(已下线)2011-2012学年河北唐山市第一中学高二年级调研考试化学试卷(已下线)2011-2012学年河北广平县第一中学高二第二次调研考试理科化学试题(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(已下线)2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(已下线)2014年高考化学一轮复习课后规范训练8-4练习卷2014-2015学年湖北省长阳县第一高级中学高二上学期期中化学试卷2015届上海理工大学附中高三上学期月考化学试卷2014-2015山西省山大附中高二12月月考化学试卷2014-2015福建省三明一中高二上学期第二次月考化学试卷2016届安徽省巢湖市无为一中高三上学期第一次月考化学试卷内蒙古赤峰二中2017-2018学年高二上学期第二次月考化学试题内蒙古赤峰二中2017-2018学年高二上学期第一次月考化学试题广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题(已下线)2018年9月30日《每日一题》人教选修4每周一测【全国百强校】河北省石家庄市第二中学2018-2019学年高二第一学期12月月考化学试题2019年广东省汕头市高三第一次模拟考试化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题(已下线)上海市奉贤区2014届高三1月调研(期末)测试化学试题新疆伊犁奎屯市第一高级中学2020-2021学年高二上学期期末考试化学试题广东省揭阳普宁二中2021届上学期高三第二次月考化学试题上海市实验学校2021-2022学年高三下学期4月月考化学试题上海市川沙中学2021-2022学年高三下学期5月月考化学试题河北省行唐启明中学2022-2023学年高二上学期期末考试化学试题
2 . 磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_____________________________ 。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为__________ ③加入NH4F将___________ 离子(填离子符号)沉淀除去。
(3)碳化结晶时,反应的离子方程式为_____________________________________ 。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是________________ 。流程中能循环利用的物质除了氯化铵之外还有____________ 。
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
则产品的纯度=__________ ,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_______ (填“偏高”“ 偏低”或“无影响”)。
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol• L -1形成M(OH) n沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
| 开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
| 沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为
(3)碳化结晶时,反应的离子方程式为
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
| 滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 20.20 |
| 2 | 1.32 | 21.32 |
| 3 | 1.05 | 20.95 |
则产品的纯度=
您最近一年使用:0次
解题方法
3 . 下表中的实验操作能达到实验目的或能得出相应结论的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解且有无色无味气体产生 | 验证Ksp(BaSO4)<Ksp(BaCO3) |
| B | 将混有Ca(OH)2杂质的Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。 | 除去Mg(OH)2样品中Ca(OH)2杂质 |
| C | 向某黄色溶液中加入淀粉KI溶液,溶液变为蓝色 | 该溶液中含Br2 |
| D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 | HSO3-结合H+的能力比SO32-的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下表是3种物质的溶解度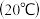 ,下列说法中正确的是
,下列说法中正确的是
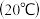 ,下列说法中正确的是
,下列说法中正确的是
| 物质 |  |  | 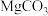 |
溶解度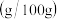 | 74 |  84 84 |  |
A.已知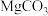 的 的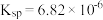 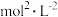 ,则所有含有固体 ,则所有含有固体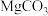 的溶液中,都有 的溶液中,都有 ,且 ,且 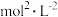 |
B.除去粗盐中含有的 杂质,最佳除杂试剂为 杂质,最佳除杂试剂为 溶液 溶液 |
| C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 |
D.用石灰水处理含有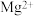 和 和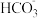 的硬水,发生的离子反应方程式为 的硬水,发生的离子反应方程式为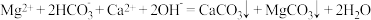 |
您最近一年使用:0次
2019-12-31更新
|
235次组卷
|
12卷引用:2015届江西省南昌三中高三上学期第六次考试理综化学试卷
2015届江西省南昌三中高三上学期第六次考试理综化学试卷江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题(已下线)2014高考化学名师选择题专练 电解质溶液练习卷2015年湖北省荆门市高三元月调考理综化学试卷2016-2017学年湖南省娄底市双峰一中等五校高二上期中化学卷河南省洛阳市2018届高三上学期尖子生第一次联考化学试题河南省汝州市实验中学2019届高三上学期期末模拟化学试题(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》2020届高三化学大二轮增分强化练—— 离子方程式及其应用夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——溶度积常数及相关计算2020届高三化学化学二轮复习——常考题型:浓度积及浓度积常数【精编24题】河北省石家庄市藁城区第一中学2021-2022学年高二上学期12月月考化学试题
名校
解题方法
5 . 下列实验能达到实验目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向FeCl3+3KSCN Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 | 说明增加生成物浓度,平衡逆向移动 |
| C | 向盛有AgCl悬浊液的试管中滴加0.1mol·L-1NaI溶液,浊液变黄 | 证明相同温度下, KSP(AgCl)>KSP(AgI) |
| D | 酸式滴定管中硫酸液面在20.00mL,将滴定管中液体全部放出 | 量取20.00mL硫酸溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-29更新
|
175次组卷
|
2卷引用:江西省新余市分宜中学2019-2020学年高二上学期第二次段考化学试题
6 . 在 时,FeS的
时,FeS的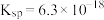 ,CuS的
,CuS的 ,ZnS的
,ZnS的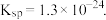 常 温时下列有关说法中正确的是
常 温时下列有关说法中正确的是
 时,FeS的
时,FeS的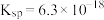 ,CuS的
,CuS的 ,ZnS的
,ZnS的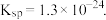 常 温时下列有关说法中正确的是
常 温时下列有关说法中正确的是| A.FeS的溶解度大于CuS的溶解度 |
B.饱和CuS溶液中 的浓度为 的浓度为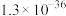  |
C.向物质的量浓度相同的 、 、 的混合液中加入少量 的混合液中加入少量 ,只有FeS沉淀生成 ,只有FeS沉淀生成 |
D.向饱和ZnS溶液中加入少量 固体,ZnS的 固体,ZnS的 变大 变大 |
您最近一年使用:0次
2019-12-26更新
|
492次组卷
|
18卷引用:【全国百强校】四川省棠湖中学2018-2019学年高二下学期开学考试化学试题
【全国百强校】四川省棠湖中学2018-2019学年高二下学期开学考试化学试题广东省汕头市2018-2019学年高二第二学期普通高中教学质量监测化学试题山东省淄博市实验中学2020届高三上学期第一次月考化学试题山东省胶州市胶州一中2020届高三10月月考化学试题重庆市云阳江口中学校2019-2020学年高二上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算2019年秋高三化学复习强化练习—— 难溶电解质的沉淀溶解平衡(已下线)2020年1月5日《每日一题》人教版(选修4)—— 每周一测辽宁省瓦房店市高级中学2019-2020学年高二上学期期末考试化学试题2020届高考二轮复习《水溶液中的离子平衡》练习题江西省南昌市八一中学2022-2023学年高二上学期1月期末考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期11月期中考试化学试题(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)天津市第二十一中学2021-2022学年高二上学期期中检测化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡(已下线)第5讲 难溶电解质的溶解平衡
7 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
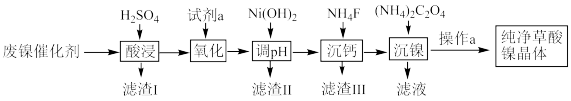
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________ 。
(3)“调pH”时pH的调控范围为__________________ 。
(4)写出“沉镍”时发生反应的离子方程式:________________________________ ,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________ ,当Ca2+沉淀完全时,溶液中c(F-)>____________ mol·L-1(写出计算式即可)。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
您最近一年使用:0次
2019-12-24更新
|
148次组卷
|
2卷引用:江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题
8 . 下列实验能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 取两支试管,分别加入4mL 0.01mol/L KMnO4酸性溶液,然后向一支试管中加入0.1mol/L H2C2O4溶液2mL,向另一支试管中加入0.1mol/L H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-23更新
|
131次组卷
|
2卷引用:江西省吉安市吉水二中、新干二中、吉安县二中、永丰二中、泰和二中五校2019-2020学年高二期中联考化学试题
11-12高二下·云南曲靖·阶段练习
名校
解题方法
9 . 为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是( )
| A.NaOH | B.Na2CO3 | C.氨水 | D.MgO |
您最近一年使用:0次
2019-12-21更新
|
149次组卷
|
19卷引用:江西省赣州市第四中学2016-2017学年高二上学期第二次月考化学试题
江西省赣州市第四中学2016-2017学年高二上学期第二次月考化学试题(已下线)2011-2012学年云南省会泽县第一中学高二6月月考化学试卷(已下线)2013-2014学年河北省邯郸市高二上学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 16盐类水解的应用练习卷2016-2017学年河北省冀州中学高二上第三次月考化学卷2016-2017学年内蒙古包头一中高二上学期期中化学试卷2016-2017学年陕西西安一中高二上月考二化学卷宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题河北省故城县高级中学2018届高三12月月考化学试题【校级联考】湖南省醴陵二中、醴陵四中2018-2019学年高二上学期期中联考化学试题【全国百强校】内蒙古集宁市集宁一中2017-2018学年高二上学期期中考试化学试题高二人教版选修4 第三章 第三节 盐类的水解宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期第二次月考化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第二次阶段考试化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题云南省丽江市华坪县第一中学2019—2020学年高二上学期期末考试化学试题吉林省汪清县汪清第四中学2020-2021学年高二上学期第二阶段考试化学试题(已下线)3.3.3 盐类水解的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)第2课时 沉淀的溶解与生成、转化及应用
名校
10 . 对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O HCl+HClO,氯水中加入碳酸钙,漂白性增强 HCl+HClO,氯水中加入碳酸钙,漂白性增强 |
B.ZnS + Cu2+ CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) |
C.2NO2 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 |
D.Cr2O72-(橙色)+H2O 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 |
您最近一年使用:0次
2019-12-19更新
|
1126次组卷
|
10卷引用:江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题
江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题北京市朝阳区2018-2019学年高二第二学期期末统一考试化学试题山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题河北省张家口市第一中学2019-2020学年高二12月月考(实验班)化学试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题新疆昌吉市教育共同体2019-2020学年高二年级上学期期末考试化学试题第2章《化学键 化学反应规律》单元测试——鲁科版(2019)必修第二册2020年北京高二下学期 复习模拟试题二(选修4人教版)新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题黑龙江省鸡东二中2020-2021学年高二上学期期末考试化学试题



