解题方法
1 . 下列结论或目的与实验内容相对应且正确的是
| 选项 | 实验内容 | 结论或目的 |
| A | 向相同物质的量浓度的NaCl、NaI混合溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | 相同温度时 Ksp(AgI) <Ksp(AgCl) |
| B | 向淀粉溶液中滴加适量稀硫酸并加热,一段时间后再滴加适量新制Cu(OH)2悬浊液并加热,没有出现红色沉淀 | 淀粉没有水解 |
| C | 将一定量铁与稀硝酸混合,待铁全部溶解后再向溶液中加入几滴KSCN溶液,溶液没有变红色 | 铁只能被稀硝酸氧化为Fe2+ |
| D | 室温时,将等体积、等物质的量浓度的FeCl3,CuSO4溶液分别加入到等体积的30%的H2O2溶液中 | 探究Fe3+、Cu2+ 的催化效果 的优劣 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
12-13高二下·云南大理·阶段练习
名校
2 . 在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
下列叙述错误的是
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10−10 | 8.3×10−17 | 6.3×10−50 |
| A.沉淀转化的实质就是沉淀溶解平衡的移动 |
| B.溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的 |
| D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
您最近一年使用:0次
2020-05-18更新
|
100次组卷
|
24卷引用:江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题
江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题(已下线)2012-2013学年云南省大理州宾川县第四高级中学高二6月月考化学卷(已下线)2014年高中化学人教版选修四第三章 水溶液中的离子平衡练习卷2015届海南省高三5月模拟化学试卷2014-2015学年广东省广州地区人教版高二上期末化学理试卷2015-2016学年陕西省西安中学高二上诊断检测化学试卷2015-2016学年黑龙江省实验中学高二上期末考试化学试卷2015-2016学年广西柳州铁路一中高二上期末理化学试卷2016-2017学年吉林省长春实验中学高二上9月月考化学卷2016-2017学年黑龙江省鹤岗一中高二上学期期中化学试卷2016-2017学年山西省大同一中高二12月月考化学试卷【全国百强校】黑龙江省大庆市铁人中学2018-2019学年高二上学期期中考试化学试题(已下线)2018年11月19日 《每日一题》人教选修4-沉淀的转化(已下线)2019年11月18日 《每日一题》高二化学人教版(选修4)——沉淀的转化宁夏银川市兴庆区长庆高级中学2019-2020学年高二上学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二上学期12月月考化学试题黑龙江省大庆市铁人中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 沉淀溶解平衡及其影响因素 (提升练习)山西省太原市山西省实验中学2019-2020学年高二上学期12月月考化学试题宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷(已下线)练习12 难溶电解质的溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版)安徽省六安市新安中学2020-2021学年高二12月月考化学(B)试题甘肃省嘉峪关市第一中学2020-2021学年高二下学期期中考试化学试题第2课时 沉淀溶解平衡的应用
3 . 25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
 Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是| A.若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大 |
| B.若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动 |
| C.若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色 |
| D.若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大 |
您最近一年使用:0次
2020-05-18更新
|
296次组卷
|
12卷引用:苏教版高三单元精练检测八化学试题
苏教版高三单元精练检测八化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题吉林省四平市双辽市第二中学2019-2020学年高二上学期期末考试化学试题山西省太原市山西省实验中学2019-2020学年高二上学期12月月考化学试题广西南宁市第三中学2019-2020学年高二下学期期中段考化学试题四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题江西省宜春市丰城中学2022-2023学年高二上学期期末考试化学试题广西桂林市第十八中学2020-2021学年高二下学期期中考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第三次月考化学试题福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡新疆实验中学2023-2024学年高二上学期期中考试化学试题
4 . 某温度下,向50 mL饱和CuCl溶液中缓慢加入NaI固体并搅拌,溶液中c(I-)与c(Cu+)的变化曲线如图所示,已知:Ksp(CuI)=1.0×10-12,下列说法正确的是


| A.Ksp(CuCl)=1.0×10-9 |
| B.图示中的x为10-6 |
| C.向CuI饱和溶液中加入淀粉会出现蓝色 |
| D.曲线bc段内,c(Cl-):c(I-)=106 |
您最近一年使用:0次
2020-05-18更新
|
211次组卷
|
2卷引用:江西省南昌市第二中学2020届高三5月模拟理综化学试题
18-19高三上·江西南昌·阶段练习
解题方法
5 . 下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有漂白粉溶液的试管中加浓硫酸 | 产生黄绿色气体 | 浓硫酸具有氧化性 |
| B | 向SO2水溶液中滴入几滴BaCl2溶液,振荡 | 出现白色沉淀 | 此沉淀是BaSO4 |
| C | 使装有NO2气体的密闭容器减小体积 | 气体颜色先变深、而后变浅 | 气体颜色变浅原因是:2NO2⇋N2O4 |
| D | 先向2mL 0.1mol/L Na2S溶液中滴入几滴0.1mol/L ZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018·江西南昌·模拟预测
名校
6 . 下列说法正确的是( )
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B.SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3 |
| C.将Fe(NO3)3样品溶于稀硫酸后,滴加KSCN溶液,变红,不能说明样品变质 |
| D.室温下,SiO2(s)+3C(s) ═ SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0 |
您最近一年使用:0次
7 . 已知常温下,Ksp(Ag2SO4)=2.0×10-5。取适量Ag2SO4溶于蒸馏水得到200 mL饱和溶液,在该饱和溶液中c(SO42-)=0.017 mol·L-1。向该饱和溶液中加入0.020 mol·L-1 Na2SO4溶液200 mL,得到溶液R。(不考虑混合后溶液体积的变化)下列说法正确的是
| A.R中c(Ag+)=2c(SO42-) |
| B.得到溶液R的过程中会产生沉淀 |
| C.R中c(Ag+)=0.017 mol·L-1 |
| D.加入Na2SO4溶液促进沉淀溶解平衡向左移动 |
您最近一年使用:0次
名校
解题方法
8 . 下列叙述中不正确的是
| A.对于阴阳离子个数比相同的难溶电解质,溶度积大的溶解度也大 |
| B.向含有Ca(OH)2固体的溶液中加入适量的水使Ca(OH)2溶解,又达到平衡时,Ca(OH)2的溶度积不变 |
| C.将难溶电解质放入纯水中,达到沉淀溶解平衡时,难溶电解质电离出的离子的浓度之积就是该难溶电解质的溶度积 |
| D.AgCl水溶液的导电性很弱,但AgCl是强电解质 |
您最近一年使用:0次
2020-04-29更新
|
74次组卷
|
2卷引用:江西省萍乡市莲花中学2019-2020高一下学期3月特色班月考化学试题
9 . 25℃时,在Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-1g(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。
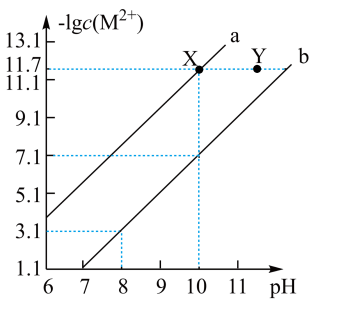
下列说法正确的是 ( )

下列说法正确的是 ( )
| A.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 |
| B.b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1(mol/L)3 |
| C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=1:104.6 |
| D.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
您最近一年使用:0次
2020-04-27更新
|
510次组卷
|
12卷引用:江西省上高县第二中学2018届高三第七次月考理科综合-化学试题
江西省上高县第二中学2018届高三第七次月考理科综合-化学试题黑龙江省哈尔滨市第六中学2017届高三下学期第三次模拟考试理科综合化学试题河南省南阳市第一中学2017-2018学年高二上学期第三次月考化学试题辽宁省大连市旅顺口区2020届高三上学期期中考试化学试题山东省实验中学2020届高三上学期第二次诊断考试化学试题山东省枣庄市2020届高三上学期期末考试化学试题河北省衡水市枣强中学2019-2020学年高二下学期第一次月考化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编河北省张家口宣化一中2021届高三上学期期末考试化学试题黑龙江省大庆铁人中学2021届高三下学期5月第三次模拟考试理综化学试题(已下线)模块十 水溶液中的离子平衡(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)
19-20高二上·江西南昌·期末
名校
10 . 根据下列实验操作和现象能得出相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S酸性比H2SO4强 |
| B | 向2mL0.1mol/LNaOH溶液中 1、滴加几滴浓度相同的MgSO4溶液,产生白色沉淀 2、再滴加几滴同浓度FeCl3溶液,产生红褐色沉淀 | 溶解度:Fe(OH)3<Mg(OH)2 |
| C | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 反应物浓度越大,反应速率越大 |
| D | 取5 mL 0.1 mol⋅L−1KI溶液,加入1 mL 0.1 mol⋅L−1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



