 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=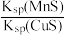 |
 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色) 等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: (1)Cr3+与Al3+的化学性质相似, 在Cr2(SO4) 3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol/L的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应
②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的
 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
| A.25℃时,CuS的溶解度大于MnS的溶解度 |
| B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L |
| C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
4 . 已知氢氧化钙和钨酸钙(CaWO4都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应I: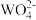 (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:
(aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:

(1)①计算T1时,Ksp(CaWO4)=
②T1
(2)①反应I平衡常数K的表达式为
②该反应的△H
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值直相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol/L]中,加入过量Ca(OH)2,反应达到平衡后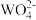 的沉淀率为60%,此时
的沉淀率为60%,此时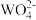 的平衡浓度为
的平衡浓度为
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| A.A | B.B | C.C | D.D |
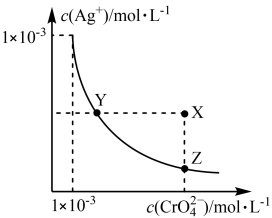
| A.t℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t℃时,Ag2CrO4的Ksp为1×10−8 |
| D.t℃时,将0.01 mol·L−1 AgNO3溶液滴入20 mL 0.01 mol·L−1 KCl和0.01 mol·L−1 K2CrO4的混合溶液中,Cl-先沉淀 |

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3
| A.曲线A表示c(Fe2+)与NaOH溶液体积的关系 |
| B.当V(NaOH溶液)=30mL时,Cr2+开始沉淀 |
| C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 |
| D.当V(NaOH溶液)>30mL时,溶液中c(Fe2+):c(Cr2+)=4 |
几种金属离子的氢氧化物沉淀pH如表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 5.2 |
Fe2+ | 7.6 | 9.7 |
Ni2+ | 7.1 | 9.2 |
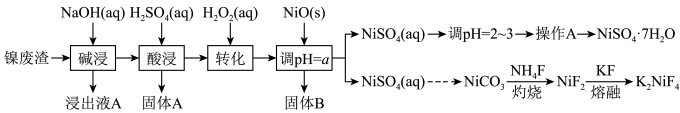
(1)“碱浸”过程中,为提高浸出率,可采取的措施是
(2)“转化”过程中加入H2O2的目的是
(3)调节pH=a,其中a的取值范围是
(4)写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:
(5)准确称取ωg翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250mL溶液,取25.00mL所配溶液于锥形瓶中,用cmol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02mL、19.98mL、19.50mL,则翠矾的纯度为
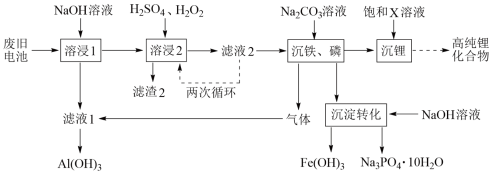
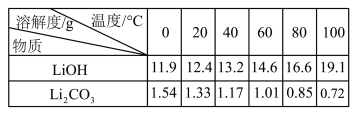
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为
(2)完成“溶浸2”反应的离子方程式
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ =
= Li++
Li++ +
+ H2PO4-+
H2PO4-+ H2O
H2O(3)“滤渣2”的主要成分是
(4)“滤液2”循环两次的目的是
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为
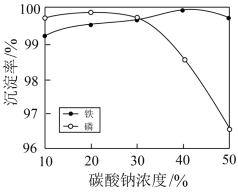
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是
A.NaOH20-40℃B.NaOH80-100℃
C.Na2CO320-40℃D.Na2CO360-80℃
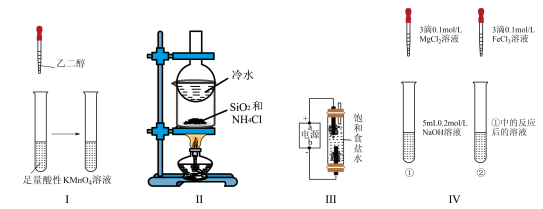
| A.I将乙二醇转化为乙二酸 |
| B.II分离SiO2和NH4Cl |
| C.III制备少量含NaClO的消毒液 |
| D.IV证明该温度下溶度积常数:Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |



