名校
1 . (1)醋酸钠水溶液pH>7,原因是(用离子方程式表示):_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的_______ 。
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于_______
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为_______ mol·L-1,pH为_______ 。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入适量的
(4)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于
(5)已知Ksp(BaSO4)=1.1×10-10,若向50mL0.008mol·L-1的BaCl2溶液中加入50mL0.01mol·L-1的硫酸,混合后溶液中的Ba2+的浓度为
您最近一年使用:0次
2021-03-02更新
|
213次组卷
|
3卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题
2 . 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断正确的是
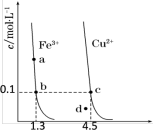

| A.升温可使溶液由a点变到b点 |
B.Ksp[Cu(OH)2]=1.0 10-20 10-20 |
| C.c点变成d点,可以往溶液中加少许Cu(OH)2固体 |
| D.FeCl3溶液中含有少量Cu2+,可以通过调节溶液pH除去 |
您最近一年使用:0次
3 . 已知一定温度下: ,下列叙述正确的是
,下列叙述正确的是
 ,下列叙述正确的是
,下列叙述正确的是A.AgCl在饱和NaCl溶液中的 比在纯水中的小 比在纯水中的小 |
B.AgCl悬浊液中: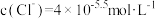 |
C.将 溶液滴入等体积 溶液滴入等体积 的KCl溶液中,最终无沉淀析出 的KCl溶液中,最终无沉淀析出 |
D.向AgCl悬浊液中加入NaBr溶液白色沉淀转化为淡黄色,说明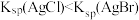 |
您最近一年使用:0次
2021-01-25更新
|
315次组卷
|
15卷引用:2016-2017学年四川省简阳市高二上学期期末化学试卷
2016-2017学年四川省简阳市高二上学期期末化学试卷2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷【校级联考】安徽省宿州市十三所重点中学2018-2019学年高二(理科)第一学期期末质量检测化学试题【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高二下学期入学摸底考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期期末考试化学试题安徽省合肥市庐江县2019-2020学年高二上学期期末检测化学试题安徽省安庆市怀宁县第二中学2019届高三上学期第五次月考化学试题黑龙省哈尔滨市宾县第二中学2020-2021学年高二上学期第二次月考化学试题内蒙古自治区奈曼旗第一中学2020-2021学年高二上学期期中考试化学试题河北省任丘市第一中学2020-2021学年高二上学期第二次阶段考试化学试题吉林省吉化第一高级中学校2020-2021学年高二上学期11月月考化学试题江西省赣州市崇义县崇义中学2020-2021学年高二下学期开学考化学试题山西省太原市2020-2021学年高二上学期期末化学(理)试题吉林省吉化第一高级中学校2020-2021学年高二上学期期末考试化学试题安徽省安庆市怀宁县第二中学2021届高三上学期第五次月考化学试题
4 . 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7
SrCO3(s) Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为__ ;该反应的平衡常数表达式为__ 。
(2)对于上述反应,实验证明增大CO 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
①升高温度,平衡常数K将__ 。
②增大CO 的浓度,平衡常数K将
的浓度,平衡常数K将__ 。
已知:SrSO4(s)
 Sr2+(aq)+SO
Sr2+(aq)+SO (aq)Ksp=2.5×10-7
(aq)Ksp=2.5×10-7SrCO3(s)
 Sr2+(aq)+CO
Sr2+(aq)+CO (aq)Ksp=2.5×10-9
(aq)Ksp=2.5×10-9(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO
 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”)。①升高温度,平衡常数K将
②增大CO
 的浓度,平衡常数K将
的浓度,平衡常数K将
您最近一年使用:0次
名校
5 . (1)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入___________ (填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______ mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与___________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
(2)已知肼(N2H4)是一种清洁高效的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。该反应的热化学方程式:___________ 。
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:

①写出电池中通入电池中通入N2H4的一极的电极的反应:___________ 。
②电池工作时,正极附近的pH___________ (填“增大”或者“不变”或者“减小”)。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3,为了得到纯净的MgCl2·2H2O晶体,应加入
②常温下,若将0.01 mol·L-1 MgCl2溶液与
(2)已知肼(N2H4)是一种清洁高效的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。该反应的热化学方程式:
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:

①写出电池中通入电池中通入N2H4的一极的电极的反应:
②电池工作时,正极附近的pH
您最近一年使用:0次
2021-01-09更新
|
133次组卷
|
2卷引用:江西省吉安县立中学2020-2021学年高二上学期期中考试化学试题
6 . 软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如下:

已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为___________ ;
(2)第1步除杂中加入H2O2的目的是___________ 。
(3)第1步除杂中形成滤渣l的主要成分为___________ (填化学式),调pH至5-6所加的试剂,可选择___________ (填以下试剂的序号字母)
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式___________ ,该反应的平衡常数数值为___________ 。(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是___________ 。

已知:①部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(2)第1步除杂中加入H2O2的目的是
(3)第1步除杂中形成滤渣l的主要成分为
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式
(5)采用“趁热过滤”操作的原因是
您最近一年使用:0次
2021-01-04更新
|
113次组卷
|
2卷引用:江西省南昌市第十中学2020-2021学年高二上学期第二次月考化学试题
解题方法
7 . 锌是一种应用广泛的金属。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为______ 。
(2)滤渣1的主要成分除SiO2外还有______ 。
(3)氧化除杂工序中通入氧气的作用是______ ,ZnO的作用是______ 。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为______ 。能否省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+______ 。
(5)改逬的锌冶炼工艺,采用了“氧压酸浸”(即酸性条件下充入高压的氧气)的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为______ 。

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为
(2)滤渣1的主要成分除SiO2外还有
(3)氧化除杂工序中通入氧气的作用是
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(5)改逬的锌冶炼工艺,采用了“氧压酸浸”(即酸性条件下充入高压的氧气)的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生的主要反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 一定温度下,AgCl(s)⇌Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是


| A.a、b、c三点对应的Ksp不相等 |
| B.AgCl在c点的溶解度比b点的大 |
| C.AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-) |
| D.b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化 |
您最近一年使用:0次
2020-12-24更新
|
229次组卷
|
5卷引用:山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题
山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题江西省上饶市2021-2022学年高二上学期期末质量检测化学试题(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第5讲 难溶电解质的溶解平衡山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题
9 . 锅炉中最难清洗的锅垢是硫酸钡固体,298K时工业上常使用碳酸钠溶液进行处理:BaSO4(s)+CO (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) K(298K)=0.1
(aq) K(298K)=0.1
(1)若平衡溶液中c(SO )为0.1mol·L-1,则c(CO
)为0.1mol·L-1,则c(CO )=
)=___ mol·L-1。
(2)锅炉经过碳酸钠处理后,倒出溶液,再向锅中加入一定量的醋酸溶液,目的是___ (用化学方程式表示)。
(3)需要处理0.1molBaSO4,加入1LNa2CO3溶液,碳酸钠的物质的量浓度是___ mol·L-1。平衡溶液中c(CO )=
)=___ mol·L-1。
 (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) K(298K)=0.1
(aq) K(298K)=0.1(1)若平衡溶液中c(SO
 )为0.1mol·L-1,则c(CO
)为0.1mol·L-1,则c(CO )=
)=(2)锅炉经过碳酸钠处理后,倒出溶液,再向锅中加入一定量的醋酸溶液,目的是
(3)需要处理0.1molBaSO4,加入1LNa2CO3溶液,碳酸钠的物质的量浓度是
 )=
)=
您最近一年使用:0次
名校
10 . 为达到相应实验目的,下列实验设计可行的是
| 编号 | 实验目的 | 实验过程 |
| A | 探究浓度对反应速率的影响 | 向2支盛有 酸性 酸性 溶液的试管中分别加入 溶液的试管中分别加入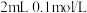 和 和 的 的 溶液,观察溶液褪色所需时间 溶液,观察溶液褪色所需时间 |
| B | 探究溶度积: | 向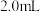 浓度均为 浓度均为 的 的 和 和 的混合溶液中滴加1~2滴 的混合溶液中滴加1~2滴 溶液,观察产生沉淀的颜色 溶液,观察产生沉淀的颜色 |
| C | 检测溶液中是否存在 | 取少量待测液于试管中,加入几滴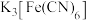 溶液,观察是否产生蓝色沉淀 溶液,观察是否产生蓝色沉淀 |
| D | 除去碱式滴定管内的气泡 | 将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-19更新
|
350次组卷
|
2卷引用:湖北省荆州市2021届高三上学期第一次质量检查化学试题



