名校
解题方法
1 . 下图所示的实验,能达到实验目的的是
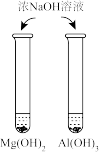 | 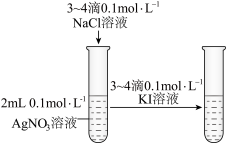 | 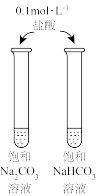 |  |
| A.比较Mg、Al金属性的强弱 | B.验证AgCl溶解度大于AgI | C.比较Na2CO3、NaHCO3与酸反应的快慢 | D.由FeCl3·6H2O制取无水FeCl3固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 常温下,FeS和ZnS的饱和溶液中,金属阳离子( )与
)与 的物质的量浓度的负对数关系如图所示。下列说法正确的是
的物质的量浓度的负对数关系如图所示。下列说法正确的是

 )与
)与 的物质的量浓度的负对数关系如图所示。下列说法正确的是
的物质的量浓度的负对数关系如图所示。下列说法正确的是
A.取一定量主要含 、 、 的浓缩液,向其中滴加 的浓缩液,向其中滴加 溶液,当ZnS开始沉淀时,溶液中的 溶液,当ZnS开始沉淀时,溶液中的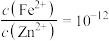 |
B.上述FeS饱和溶液中,只含有 和 和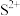 ,不含其他离子 ,不含其他离子 |
C.常温下,将足量ZnS分别加入体积均为100mL的  溶液和 溶液和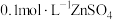 溶液中,充分搅拌后, 溶液中,充分搅拌后, 溶液中 溶液中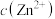 较 较 溶液中 溶液中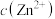 大 大 |
D.常温下,向ZnS饱和溶液中加入稀硝酸,发生的反应为 |
您最近一年使用:0次
2023-11-12更新
|
798次组卷
|
2卷引用:河北省邢台市五岳联盟2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
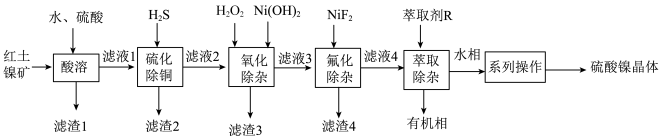
3 . 硫酸镍广泛应用于电镀、电池等工业。现以红土镍矿(主要成分为 ,含
,含 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备硫酸镍,工艺流程如下:
等杂质)为原料制备硫酸镍,工艺流程如下:
已知:①相关金属离子[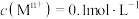 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如下:
范围如下:
②当离子完全沉淀时, 。
。
③硫酸镍晶体 可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
④硫酸镍在水中溶解度随温度变化的曲线如图所示。回答下列问题:

(1)为加快“酸溶”速率,可采取的措施有___________ (任写一条)。“滤渣2”的主要成分有 和
和___________ (填化学式)。
(2)写出“氧化除杂”过程中加入 涉及反应的离子方程式
涉及反应的离子方程式___________ 。
(3)“氧化除杂”中加入 的作用是
的作用是___________ ,溶液的 应调节为
应调节为___________  之间。
之间。
(4)萃取后的所得的水相“系列操作”包括___________ 、过滤、洗涤得到硫酸镍晶体。
(5)洗涤过程中最好选择___________进行洗涤。
 ,含
,含 、
、 、
、 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备硫酸镍,工艺流程如下:
等杂质)为原料制备硫酸镍,工艺流程如下:
已知:①相关金属离子[
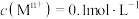 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 6.3 | 1.8 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 8.3 | 3.2 | 4.7 | 10.9 | 8.2 | 8.9 |
 。
。③硫酸镍晶体
 可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。
可溶于水,不溶于乙醇和乙醚,乙醚微溶于水。④硫酸镍在水中溶解度随温度变化的曲线如图所示。回答下列问题:

(1)为加快“酸溶”速率,可采取的措施有
 和
和(2)写出“氧化除杂”过程中加入
 涉及反应的离子方程式
涉及反应的离子方程式(3)“氧化除杂”中加入
 的作用是
的作用是 应调节为
应调节为 之间。
之间。(4)萃取后的所得的水相“系列操作”包括
(5)洗涤过程中最好选择___________进行洗涤。
| A.蒸馏水 | B.无水乙醇 | C.乙醚 | D.稀盐酸 |
您最近一年使用:0次
2023-10-23更新
|
189次组卷
|
2卷引用:贵州省黔东南州从江县2023-2024学年高三上学期期中检测化学试题
4 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-06-10更新
|
18521次组卷
|
18卷引用:山东省滨州市2023-2024学年高三上学期11月期中考试化学试题
山东省滨州市2023-2024学年高三上学期11月期中考试化学试题2023年高考新课标理综化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
名校
解题方法
5 . 镁基储氢材料MgH2具有储氢量高、成本低廉等优点,发展前景广阔。
Ⅰ.MgH2热分解放出H2
MgH2(s) Mg(s)+H2(g) ΔH=+75kJ/mol
Mg(s)+H2(g) ΔH=+75kJ/mol
该反应的能量变化如图。

(1)E1=_____ 。
(2)提高H2平衡产率的措施有_____ (答2条)。
Ⅱ.MgH2水解制备H2
(3)MgH2与H2O反应制备H2的化学方程式是_____ 。
(4)MgH2与H2O反应时,最初生成H2的速率很快,但随后变得很缓慢,原因是_____ 。
(5)MgCl2、NiCl2、CuCl2等盐溶液能提升MgH2的水解性能。1mol/L的几种盐溶液对MgH2水解制备H2的性能曲线如图。

已知:ⅰ.
ⅱ.MgH2在MCl2(M代表Mg、Ni、Cu)溶液中水解的示意图如图。

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是_____ 。
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是_____ 。
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是_____ 。
Ⅰ.MgH2热分解放出H2
MgH2(s)
 Mg(s)+H2(g) ΔH=+75kJ/mol
Mg(s)+H2(g) ΔH=+75kJ/mol该反应的能量变化如图。

(1)E1=
(2)提高H2平衡产率的措施有
Ⅱ.MgH2水解制备H2
(3)MgH2与H2O反应制备H2的化学方程式是
(4)MgH2与H2O反应时,最初生成H2的速率很快,但随后变得很缓慢,原因是
(5)MgCl2、NiCl2、CuCl2等盐溶液能提升MgH2的水解性能。1mol/L的几种盐溶液对MgH2水解制备H2的性能曲线如图。

已知:ⅰ.
| 物质 | Mg(OH)2 | Ni(OH)2 | Cu(OH)2 |
| Ksp | 5.6×10-12 | 5.5×10-16 | 2.2×10-20 |

①NiCl2溶液制备H2的性能优于MgCl2溶液,原因是
②MgH2在MgCl2溶液中制备H2的性能不如在NiCl2溶液中优异,但使用MgCl2溶液利于发展“镁-氢”循环经济,原因是
③CuCl2溶液制备H2的性能不如NiCl2溶液,可能的原因是
您最近一年使用:0次
2023-03-31更新
|
681次组卷
|
4卷引用:北京市第一○一中学2023-2024学年高二上学期期中练习化学试题
6 . 已知:T℃时,Ksp(CaSO4)=4.0×10-6、Ksp(CaCO3)=4.0×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
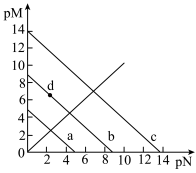

| A.a线是CaSO4沉淀溶解平衡曲线 |
| B.T℃时,向0.001mol CaCO3沉淀中加入Na2SO4溶液(反应后溶液为1L),使CaCO3沉淀会转化为CaSO4沉淀,所需Na2SO4的物质的量至少为1.001mol |
C.T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中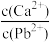 = =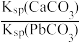 |
D.若d点表示CaCO3的饱和溶液加入CaSO4饱和溶液等体积混合则:c( )<c(Ca2+)<c(SO )<c(Ca2+)<c(SO ) ) |
您最近一年使用:0次
2023-01-13更新
|
745次组卷
|
3卷引用:浙江省宁波效实中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
7 . 氯气及氯的化合物在生产生活中具有重要的作用,回答下列问题:
I.实验室制备少量的漂白液(装置如图)。

(1)图中盛装浓盐酸的仪器名称是__________ ,为了让液体顺利流下,滴加浓盐酸前的操作是__________ 。
(2)洗气瓶的导管口应__________ (填“长进短出”或“短进长出”),饱和食盐水的作用是____________ 。
(3)制备漂白液的离子方程式为______________________________ 。
II.室温下,实验室测定 的
的 并探究
并探究 浓度对
浓度对 沉淀溶解平衡的影响。
沉淀溶解平衡的影响。
已知: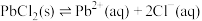 。
。
(4)将
 饱和溶液以缓慢的流速通过阳离子交换树脂,此时溶液中的
饱和溶液以缓慢的流速通过阳离子交换树脂,此时溶液中的 与树脂上的
与树脂上的 进行离子交换:
进行离子交换: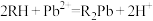 ,交换完成后,
,交换完成后, 随流出液流出,用
随流出液流出,用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 标准溶液的平均体积为
标准溶液的平均体积为 ,则
,则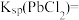
________ (用含b的代数式表示)。
(5)某实验小组同学往六个烧杯中分别加入不同体积的
 溶液,测量对应的电导率(已知温度一定时,强电解质稀溶液的离子浓度越大,电导率越大),完成表格内容。
溶液,测量对应的电导率(已知温度一定时,强电解质稀溶液的离子浓度越大,电导率越大),完成表格内容。
③该实验小组同学认为增大 的浓度,
的浓度, 沉淀溶解平衡向生成沉淀的方向移动,支持他们观点的依据是
沉淀溶解平衡向生成沉淀的方向移动,支持他们观点的依据是______________________________ 。
I.实验室制备少量的漂白液(装置如图)。

(1)图中盛装浓盐酸的仪器名称是
(2)洗气瓶的导管口应
(3)制备漂白液的离子方程式为
II.室温下,实验室测定
 的
的 并探究
并探究 浓度对
浓度对 沉淀溶解平衡的影响。
沉淀溶解平衡的影响。已知:
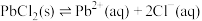 。
。(4)将

 饱和溶液以缓慢的流速通过阳离子交换树脂,此时溶液中的
饱和溶液以缓慢的流速通过阳离子交换树脂,此时溶液中的 与树脂上的
与树脂上的 进行离子交换:
进行离子交换: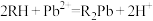 ,交换完成后,
,交换完成后, 随流出液流出,用
随流出液流出,用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 标准溶液的平均体积为
标准溶液的平均体积为 ,则
,则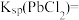
(5)某实验小组同学往六个烧杯中分别加入不同体积的

 溶液,测量对应的电导率(已知温度一定时,强电解质稀溶液的离子浓度越大,电导率越大),完成表格内容。
溶液,测量对应的电导率(已知温度一定时,强电解质稀溶液的离子浓度越大,电导率越大),完成表格内容。烧杯及溶液 | 分别加入 | 电导率 |
三个装有 | 0 |
|
① |
| |
2 |
| |
三个装有 | 0 |
|
1 |
| |
2 |
|
 的浓度,
的浓度, 沉淀溶解平衡向生成沉淀的方向移动,支持他们观点的依据是
沉淀溶解平衡向生成沉淀的方向移动,支持他们观点的依据是
您最近一年使用:0次
2022-12-01更新
|
116次组卷
|
2卷引用:新疆兵团地州学校 2022-2023 学年高三上学期一轮期中调研考试化学试题
8 .  是重要化工原料,由
是重要化工原料,由 制备
制备 一种工艺流程如下:
一种工艺流程如下:
I.研磨 ,加水配成浊液。
,加水配成浊液。
II. 浊液经还原、纯化、制备等过程,最终获得
浊液经还原、纯化、制备等过程,最终获得 固体。
固体。

资料:
① 不溶于水。该工艺条件下,
不溶于水。该工艺条件下, 与
与 不反应。
不反应。
②难溶电解质的溶度积: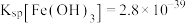 ,
,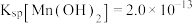
(1)研磨 的目的是
的目的是_______ 。
(2) 氧化
氧化 为
为 的离子方程式为
的离子方程式为_______ 。
①根据上述反应,还原 所需的
所需的 与
与 的物质的量比值应为2。而实际上加入的酸要少一些,请结合含铁产物解释原因
的物质的量比值应为2。而实际上加入的酸要少一些,请结合含铁产物解释原因_______ 。
②取少量母液,滴加_______ 溶液,未产生蓝色沉淀,说明溶液中不存在 。
。
(3)纯化
向母液中滴加氨水调pH,除去残留的 。若母液中
。若母液中 ,使
,使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中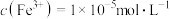 ,溶液中
,溶液中 至少为
至少为_______  ,则溶液中
,则溶液中_______ ,所以此时不会有 ,沉淀生成。(已知
,沉淀生成。(已知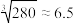 )。
)。
(4)制备
将 纯化液与稍过量的
纯化液与稍过量的 ,溶液混合,得到含
,溶液混合,得到含 的浊液。将浊液过滤,洗涤沉淀,干燥后得到
的浊液。将浊液过滤,洗涤沉淀,干燥后得到 固体。
固体。
①通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 的操作是取最后一次洗涤液,
的操作是取最后一次洗涤液,_______ ,说明沉淀已洗涤干净。
②生成 的离子方程式是
的离子方程式是_______ 。
 是重要化工原料,由
是重要化工原料,由 制备
制备 一种工艺流程如下:
一种工艺流程如下:I.研磨
 ,加水配成浊液。
,加水配成浊液。II.
 浊液经还原、纯化、制备等过程,最终获得
浊液经还原、纯化、制备等过程,最终获得 固体。
固体。
资料:
①
 不溶于水。该工艺条件下,
不溶于水。该工艺条件下, 与
与 不反应。
不反应。②难溶电解质的溶度积:
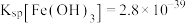 ,
,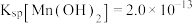
(1)研磨
 的目的是
的目的是(2)
 氧化
氧化 为
为 的离子方程式为
的离子方程式为①根据上述反应,还原
 所需的
所需的 与
与 的物质的量比值应为2。而实际上加入的酸要少一些,请结合含铁产物解释原因
的物质的量比值应为2。而实际上加入的酸要少一些,请结合含铁产物解释原因②取少量母液,滴加
 。
。(3)纯化
向母液中滴加氨水调pH,除去残留的
 。若母液中
。若母液中 ,使
,使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中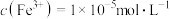 ,溶液中
,溶液中 至少为
至少为 ,则溶液中
,则溶液中 ,沉淀生成。(已知
,沉淀生成。(已知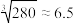 )。
)。(4)制备
将
 纯化液与稍过量的
纯化液与稍过量的 ,溶液混合,得到含
,溶液混合,得到含 的浊液。将浊液过滤,洗涤沉淀,干燥后得到
的浊液。将浊液过滤,洗涤沉淀,干燥后得到 固体。
固体。①通过检验
 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 的操作是取最后一次洗涤液,
的操作是取最后一次洗涤液,②生成
 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
9 . 工业上可利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐例制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH与金属离子在该工艺条件下的萃取率 (进入有机层中金属离子的百分数)见表。
②与铝的化学性质相似。
③当溶液中剩余离子的浓度小于10-5mol/L时,视为沉淀完全。
回答下列问题:
(1)Ga2(Fe2O4)3中Ga的化合价为___________ ,“浸出”时其发生反应的离子方程式为___________ 。
(2)滤饼的主要成分是___________ 萃取前加入的固体X为___________ 。
(3)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。写出第一步电解产生粗镓的电极反应式:___________
(4)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓(Ga(CH3)3)为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为___________
(5)由滤液可制备ZnC2O4·2H2O,再通过热分解探究其产物,已知ZnC2O4·2H2O(M=189)的TG-DTA(热重分析一差热分析)曲线如图所示。(热流:是指反应过程中,单位时间内通过反应体系传递的热量。)
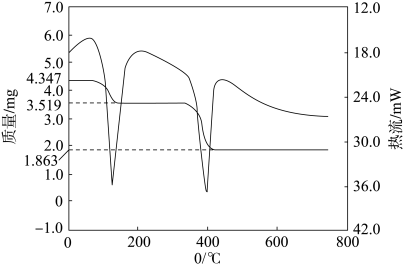
则ZnC2O4·2H2O分解是___________ 反应(填“放热”或“吸热”),分解的总化学方程式为___________ 。

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH与金属离子在该工艺条件下的萃取率 (进入有机层中金属离子的百分数)见表。
②与铝的化学性质相似。
③当溶液中剩余离子的浓度小于10-5mol/L时,视为沉淀完全。
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)Ga2(Fe2O4)3中Ga的化合价为
(2)滤饼的主要成分是
(3)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。写出第一步电解产生粗镓的电极反应式:
(4)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓(Ga(CH3)3)为原料,使其与NH3发生系列反应得到GaN和另一种产物,该过程的化学方程式为
(5)由滤液可制备ZnC2O4·2H2O,再通过热分解探究其产物,已知ZnC2O4·2H2O(M=189)的TG-DTA(热重分析一差热分析)曲线如图所示。(热流:是指反应过程中,单位时间内通过反应体系传递的热量。)

则ZnC2O4·2H2O分解是
您最近一年使用:0次
名校
解题方法
10 . 亚硝酸钠( )是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某
)是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某 样品的纯度,并对NaCl与
样品的纯度,并对NaCl与 进行鉴别。
进行鉴别。
I.甲组同学测定 样品的纯度。
样品的纯度。
称取mg试样于锥形瓶中,加入适量水溶解,然后用 的
的 溶液(适量稀
溶液(适量稀 酸化)进行滴定,并重复上述操作3次。已知:
酸化)进行滴定,并重复上述操作3次。已知: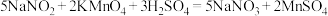
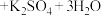 。
。
(1)甲组同学在滴定时应选用的滴定装置是_______ (填“A”或“B”)。

(2)滴定达到终点的现象是_______ 。
(3)若滴定至终点时平均消耗VmL标准溶液,则该产品的纯度为_______ (用含c、m、V的代数式表示)。
II.乙组同学设计实验鉴别NaCl和 。
。
(4)常温下,用pH试纸分别测定 两种盐溶液的pH,测得
两种盐溶液的pH,测得 溶液的pH=9,即
溶液的pH=9,即 溶液呈碱性,其原因是
溶液呈碱性,其原因是_______ (用离子方程式表示); 溶液中各离子浓度的大小关系为
溶液中各离子浓度的大小关系为_______ 。
(5)已知: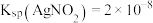 ,
, 。分别向同浓度的两种盐溶液中滴入同浓度的
。分别向同浓度的两种盐溶液中滴入同浓度的 溶液,先出现沉淀的是
溶液,先出现沉淀的是_______ (填“NaCl”或“ ”)溶液。
”)溶液。
 )是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某
)是一种工业盐,外观与食盐非常相似,但有毒。某化学兴趣小组欲测定某 样品的纯度,并对NaCl与
样品的纯度,并对NaCl与 进行鉴别。
进行鉴别。I.甲组同学测定
 样品的纯度。
样品的纯度。称取mg试样于锥形瓶中,加入适量水溶解,然后用
 的
的 溶液(适量稀
溶液(适量稀 酸化)进行滴定,并重复上述操作3次。已知:
酸化)进行滴定,并重复上述操作3次。已知: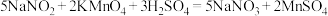
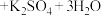 。
。(1)甲组同学在滴定时应选用的滴定装置是

(2)滴定达到终点的现象是
(3)若滴定至终点时平均消耗VmL标准溶液,则该产品的纯度为
II.乙组同学设计实验鉴别NaCl和
 。
。(4)常温下,用pH试纸分别测定
 两种盐溶液的pH,测得
两种盐溶液的pH,测得 溶液的pH=9,即
溶液的pH=9,即 溶液呈碱性,其原因是
溶液呈碱性,其原因是 溶液中各离子浓度的大小关系为
溶液中各离子浓度的大小关系为(5)已知:
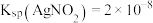 ,
, 。分别向同浓度的两种盐溶液中滴入同浓度的
。分别向同浓度的两种盐溶液中滴入同浓度的 溶液,先出现沉淀的是
溶液,先出现沉淀的是 ”)溶液。
”)溶液。
您最近一年使用:0次
2022-11-19更新
|
270次组卷
|
3卷引用:辽宁省朝阳市建平县实验中学2022-2023学年高二上学期期中考试化学试题