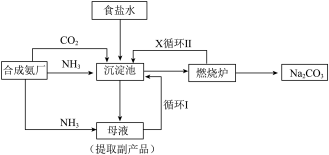
1 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示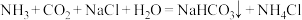 。
。
(1)“侯氏制碱法”誉满全球,其中的“碱”为_______ ,俗称_______ 。
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
(3)燃烧炉中发生反应的化学方程式为_______ 。
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了_______ (填I或Ⅱ)的循环。上述流程中X的分子式_______ 。
(5)该流程提取的副产品为_______ 。
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,_______ ,则证明含有NaCl。
 。
。(1)“侯氏制碱法”誉满全球,其中的“碱”为
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
A. | B. | C. | D.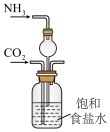 |
(3)燃烧炉中发生反应的化学方程式为
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(5)该流程提取的副产品为
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,
您最近一年使用:0次
名校
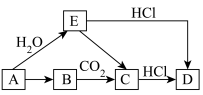
2 . Ⅰ.有如图所示各步变化(部分产物未写出),A为金属单质,B为淡黄色固体,物质A~E均含有钠元素。___________ ,D.___________ 。
(2)写出A→E的化学方程式并用双线桥标出电子转移的方向和数目:___________ 。
Ⅱ.完成下列问题
(3)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。亚铁离子极不稳定,二价铁易被空气或Cl2___________ (填“氧化”或“还原”)成三价铁,请写出亚铁离子与Cl2反应的离子方程式:___________ 。
(4)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。___________ 。
②该实验可证明NaHCO3的热稳定性___________ (填“强于”“弱于”或“等于”)Na2CO3;___________ (填“能”或“不能”)将NaHCO3、Na2CO3的位置互换。
(2)写出A→E的化学方程式并用双线桥标出电子转移的方向和数目:
Ⅱ.完成下列问题
(3)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。亚铁离子极不稳定,二价铁易被空气或Cl2
(4)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。
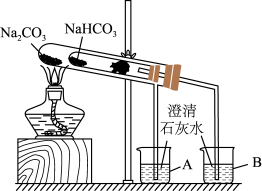
②该实验可证明NaHCO3的热稳定性
您最近一年使用:0次
3 . 在实验室中某探究小组拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备ICl,实验过程装置可重复使用。
②ICl是一种红棕色液体,熔点为13.9℃,沸点97.4℃;
③ICl遇水发生反应,也能与KI反应生成I2。
装置连接顺序为:①→③→⑤→②→⑤→④,下列说法错误的是
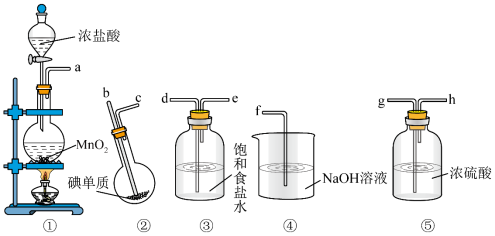
②ICl是一种红棕色液体,熔点为13.9℃,沸点97.4℃;
③ICl遇水发生反应,也能与KI反应生成I2。
装置连接顺序为:①→③→⑤→②→⑤→④,下列说法错误的是
| A.上述装置连接中④去掉也不影响实验 |
B.①装置中若用 代替MnO2,则不需要加热 代替MnO2,则不需要加热 |
| C.②装置烧瓶温度需维持在40℃左右,其目的是防止ICl挥发 |
| D.用湿润的淀粉碘化钾试纸检测ICl,试纸变蓝,说明ICl的氧化性比I2强 |
您最近一年使用:0次
解题方法
4 . 读下图信息,下列说法错误的是
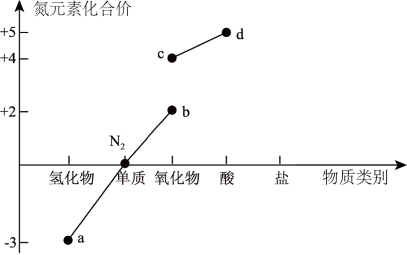
| A.a可经催化氧化生成b |
| B.b、c均为大气污染气体,在空气中可稳定存在 |
| C.Cu与d的浓溶液常温下反应可生成c |
| D.d的浓溶液保存在棕色试剂瓶中并放置在阴凉处 |
您最近一年使用:0次
名校
解题方法
5 . 下列各组离子中,在给定条件下能够大量共存的是
A.通入足量 后的溶液中: 后的溶液中: 、 、 、 、 、 、 |
B.无色溶液中: 、 、 、 、 、 、 |
C.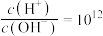 的溶液中: 的溶液中: 、 、 、 、 、 、 |
D.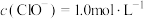 的溶液: 的溶液: 、 、 、 、 、 、 |
您最近一年使用:0次
2024-04-25更新
|
142次组卷
|
3卷引用:云南省开远市第一中学校2023-2024学年高二下学期期中考试化学试题
名校
解题方法
6 . 在 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是
 反应中,表示该反应速率最快的是
反应中,表示该反应速率最快的是A. | B.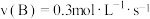 |
C. | D. |
您最近一年使用:0次
2024-04-21更新
|
414次组卷
|
2卷引用:福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
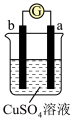
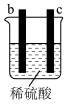
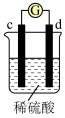
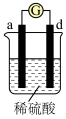
7 . 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是
| 实验装置 |
|
|
| 部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 |
| 实验装置 |
|
|
| 部分实验现象 | d极溶解,c极有气体产生 | 电流计指示在导线中电流从a极流向d极 |
A. | B. |
C. | D. |
您最近一年使用:0次
2024-04-21更新
|
207次组卷
|
6卷引用:广西来宾市忻城县高级中学2023-2024学年高一下学期期中考试化学试卷
广西来宾市忻城县高级中学2023-2024学年高一下学期期中考试化学试卷云南省下关第一中学2023-2024学年高一下学期5月期中考试化学试题湖南省邵东市第一中学2022-2023学年高一上学期期末测试化学试题宁夏石嘴山市第三中学2023-2024学年高一下学期3月月考化学试题河南省信阳高级中学2023-2024学年高一下学期4月月考化学试题(已下线)专题02 化学反应与能量变化-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
名校
解题方法
8 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时对氨水进行如下操作,请填写下列空白。
①若向氨水中加入少量硫酸铵固体,则溶液中 将
将__________ (填“增大”“减小”或“不变”)。
②若向氨水中加入稀盐酸,使氨水恰好被中 和,则此时溶液显___________ (填“酸性”“碱性”或“中性”),用离子方程式表示其原因_________________ ,此溶液中离子的浓度大小顺序为___________
③在浓度为 的氨水中加入等体积
的氨水中加入等体积 的
的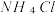 溶液,已知
溶液,已知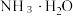 的电离常数为
的电离常数为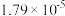 ,此时混合溶液显
,此时混合溶液显___________ (填“酸性”“碱性”或“中性”),此溶液中离子的浓度大小顺序为 ______
(2)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①上述四种酸酸性由强到弱的顺序为___________ ;
②将少量的CO2通入NaClO溶液中,反应的离子方程式:___________ 。
(1)25℃时对氨水进行如下操作,请填写下列空白。
①若向氨水中加入少量硫酸铵固体,则溶液中
 将
将②若向氨水中加入稀盐酸,使氨水恰好被
③在浓度为
 的氨水中加入等体积
的氨水中加入等体积 的
的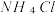 溶液,已知
溶液,已知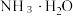 的电离常数为
的电离常数为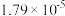 ,此时混合溶液显
,此时混合溶液显(2)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 | HCOOH | H2CO₃ | HCN | HClO |
| 电离平衡常数 | K=1.8×10⁻⁴ | K₁=4.3×10⁻⁷;K2=5.6×10⁻¹¹ | K=4.9×10⁻¹⁰ | K=4.7×10⁻⁸ |
②将少量的CO2通入NaClO溶液中,反应的离子方程式:
您最近一年使用:0次
2024-04-17更新
|
47次组卷
|
2卷引用:四川省德阳市什邡中学2023-2024学年高二下学期5月期中考试化学试题
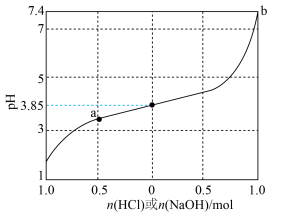
9 . 缓冲溶液是指加少量水稀释或外加少量酸、碱,自身pH不发生显著变化的溶液。1L含1mol乳酸(HLac)和1mol乳酸钠(NaLac)的溶液就是一种缓冲溶液,该溶液的pH为3.85。下图是此缓冲溶液的pH随通入HCl(g)或加入NaOH(s)的物质的量变化的示意图(溶液体积保持1L),已知lg3=0.48。下列说法错误的是
A.此缓冲溶液中(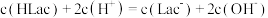 |
| B.通过计算可得出,a点溶液的pH约为3.37 |
| C.根据图像可以判断,b点溶液已失去缓冲能力 |
D.当加入NaOH,且横坐标为0.5时,对应溶液中(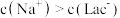 |
您最近一年使用:0次
2024-04-16更新
|
275次组卷
|
4卷引用:湖南省雅礼教育集团2023-2024学年高二下学期期中考试化学试题
名校
10 . 下列溶液的物质的量浓度的相关计算正确的是
A.同浓度的三种物质的溶液: 、 、 、 、 溶液体积之比为3∶2∶1,则 溶液体积之比为3∶2∶1,则 浓度之比为3∶2∶3 浓度之比为3∶2∶3 |
B.将100mL 5 的盐酸加水稀释至1L,再取出5mL,这5mL溶液的物质的量浓度为0.5 的盐酸加水稀释至1L,再取出5mL,这5mL溶液的物质的量浓度为0.5 |
C.将1 的NaCl溶液和0.5 的NaCl溶液和0.5 的 的 溶液等体积混合后,忽略溶液体积变化, 溶液等体积混合后,忽略溶液体积变化,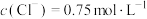 |
D.标准状况下,22.4L HCl溶于1L水,盐酸的物质的量浓度为1 |
您最近一年使用:0次