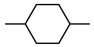
1 . 按要求回答下列问题:
(1)下列变化属于吸热反应的是______ (填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤ 固体溶于水
固体溶于水
(2)强酸与强碱的稀溶液发生中和反应生成1mol 时的反应热
时的反应热 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为______ 。(结果保留小数点后一位)
(3)已知1g 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为______ ,试写出该反应的热化学方程式为______ 。
(4)试比较反应热的大小:
①



则
______  (填“>”或“<”,下同)。
(填“>”或“<”,下同)。
②已知常温时红磷比白磷稳定。
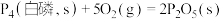

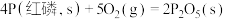

则
______  。
。
(5)已知:25℃、101kPa时,
①

②

③
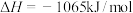
则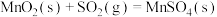

______ 。
(1)下列变化属于吸热反应的是
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤
 固体溶于水
固体溶于水(2)强酸与强碱的稀溶液发生中和反应生成1mol
 时的反应热
时的反应热 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为(3)已知1g
 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为(4)试比较反应热的大小:
①




则

 (填“>”或“<”,下同)。
(填“>”或“<”,下同)。②已知常温时红磷比白磷稳定。
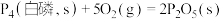

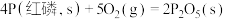

则

 。
。(5)已知:25℃、101kPa时,
①


②


③

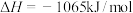
则
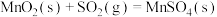

您最近一年使用:0次
2024-05-04更新
|
338次组卷
|
2卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
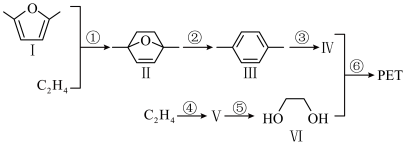
2 . PET是一种用途广泛的高分子材料,其合成的方法如图所示(反应所需的部分试剂与条件省略)。___________ 。化合物Ⅲ与酸性KMnO4溶液反应可得到化合物Ⅳ,则化合物Ⅳ的名称为___________ 。
(2)化合物Ⅴ是环状分子,与H2O加成可得到化合物Ⅵ,则化合物Ⅴ的结构简式为___________ 。
(3)化合物Ⅶ是化合物Ⅱ与足量H2加成后所得产物的一种同分异构体,其核磁共振氢谱中峰面积比为3:1:3,请写出一种符合条件的化合物Ⅶ的结构简式:___________ 。
(4)根据化合物Ⅲ的结构特征,分析预测其可能具有的化学性质,并完成下表:
(5)下列关于反应①②的说法中正确的有___________(填标号)。
(6)请以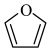 与丙烯为含碳原料,利用所学知识与上述合成路线的信息,合成化合物
与丙烯为含碳原料,利用所学知识与上述合成路线的信息,合成化合物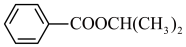 ,并基于你的合成路线,回答下列问题:
,并基于你的合成路线,回答下列问题:___________ (注明反应条件)。
(2)化合物Ⅴ是环状分子,与H2O加成可得到化合物Ⅵ,则化合物Ⅴ的结构简式为
(3)化合物Ⅶ是化合物Ⅱ与足量H2加成后所得产物的一种同分异构体,其核磁共振氢谱中峰面积比为3:1:3,请写出一种符合条件的化合物Ⅶ的结构简式:
(4)根据化合物Ⅲ的结构特征,分析预测其可能具有的化学性质,并完成下表:
| 序号 | 反应试剂、条件 | 反应生成的新结构 | 反应类型 |
| 1 |
| ||
| 2 | 取代反应 |
(5)下列关于反应①②的说法中正确的有___________(填标号)。
| A.反应①为加成反应 |
| B.化合物Ⅲ中所有原子共平面 |
| C.反应②过程中,有C-O键和C-H键的断裂 |
| D.化合物Ⅱ中,氧原子采取sp3杂化,且不含手性碳原子 |
(6)请以
 与丙烯为含碳原料,利用所学知识与上述合成路线的信息,合成化合物
与丙烯为含碳原料,利用所学知识与上述合成路线的信息,合成化合物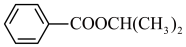 ,并基于你的合成路线,回答下列问题:
,并基于你的合成路线,回答下列问题:(a)从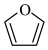 出发,第一步反应的产物为
出发,第一步反应的产物为
您最近一年使用:0次
3 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
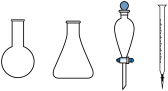
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示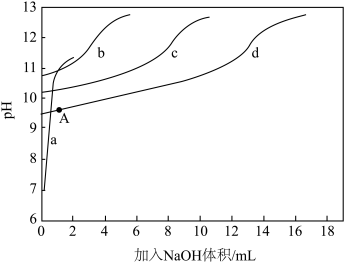
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近一年使用:0次
4 . 缓冲溶液是指加少量水稀释或外加少量酸、碱,自身pH不发生显著变化的溶液。1L含1mol乳酸(HLac)和1mol乳酸钠(NaLac)的溶液就是一种缓冲溶液,该溶液的pH为3.85。下图是此缓冲溶液的pH随通入HCl(g)或加入NaOH(s)的物质的量变化的示意图(溶液体积保持1L),已知lg3=0.48。下列说法错误的是
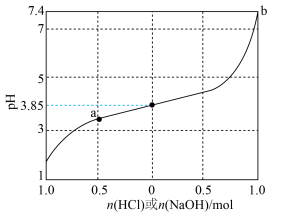
A.此缓冲溶液中(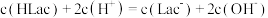 |
| B.通过计算可得出,a点溶液的pH约为3.37 |
| C.根据图像可以判断,b点溶液已失去缓冲能力 |
D.当加入NaOH,且横坐标为0.5时,对应溶液中(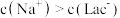 |
您最近一年使用:0次
2024-04-16更新
|
274次组卷
|
4卷引用:2024届河南省济洛平许四市高三下学期第三次质量检测(三模)理综试题-高中化学
名校
解题方法
5 . 镁―空气中性燃料电池是一种能被海水激活的电池,其能量比干电池高20~50倍。实验小组以该燃料电池为电源制备 ,工作原理示意图如图所示。下列说法错误的是
,工作原理示意图如图所示。下列说法错误的是
 ,工作原理示意图如图所示。下列说法错误的是
,工作原理示意图如图所示。下列说法错误的是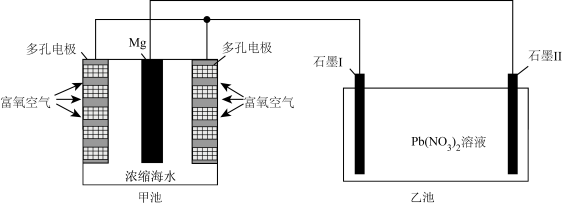
| A.工作时,乙池可能产生导致光化学污染的气体 |
| B.石墨电极Ⅱ增重239g时,外电路中流过2mol电子 |
C.工作时,电源的正极反应式为 |
| D.采用多孔电极有利于增大接触面积便于氧气扩散 |
您最近一年使用:0次
2024-04-07更新
|
735次组卷
|
6卷引用:云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷
云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷2024届四川省雅安市天全中学高三下学期模拟预测化学试题(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)题型8 反应热 电化学的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题河南省许昌高级中学2023-2024学年高三下学期5月月考化学试题
6 . 布洛芬是一种常用药物,一种由丁酸制备布洛芬的合成路线如图:

已知:ClSO2H 是一种强酸,易分解为HCl和SO2。
回答下列问题:
(1)A的结构简式为___________ ,其用系统命名法命名的名称为___________ 。
(2)上述A→G的合成路线中,属于取代反应的共有___________ 步,E中官能团名称为___________ 。
(3)写出A→B的化学方程式:___________ 。
(4)有机物 H 是 C 的同分异构体,符合下列条件的 H 有___________ 种,其中存在手性碳原子的分子的结构简式为___________ (任写 种)。
①分子中仅有一种官能团
②含有苯环,无其他环状结构
③苯环上仅有一种取代基
(5)以乙醇和苯为原料,其他无机试剂和必要的有机试剂任选,设计合成苯乙烯的路线___________ 。

已知:ClSO2H 是一种强酸,易分解为HCl和SO2。
回答下列问题:
(1)A的结构简式为
(2)上述A→G的合成路线中,属于取代反应的共有
(3)写出A→B的化学方程式:
(4)有机物 H 是 C 的同分异构体,符合下列条件的 H 有
①分子中仅有一种官能团
②含有苯环,无其他环状结构
③苯环上仅有一种取代基
(5)以乙醇和苯为原料,其他无机试剂和必要的有机试剂任选,设计合成苯乙烯的路线
您最近一年使用:0次
7 . 化合物W是合成风湿性关节炎药物罗美昔布的一种中间体,其合成路线如下:
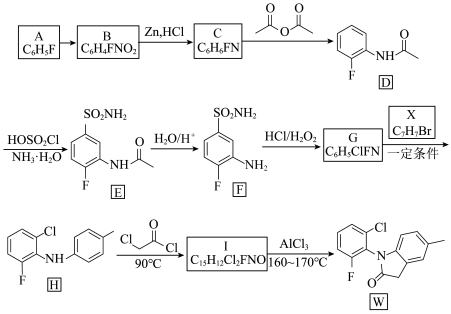
已知:(ⅰ)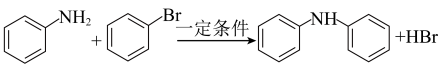
(ⅱ)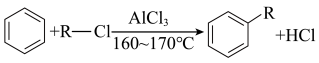
回答下列问题:
(1)A的化学名称是__________ ,B中具有的官能团的名称是__________ 。
(2)由B生成C的反应类型是__________ 。
(3)写出由G生成H的化学方程式:__________ 。
(4)写出I的结构简式:__________ 。
(5)X的同分异构体中,符合下列条件的有机物有__________ 种。
ⅰ)只含两种官能团且不含甲基;
ⅱ)含 结构,不含C=C=C和环状结构。
结构,不含C=C=C和环状结构。
(6)设计由甲苯和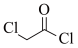 制备
制备 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)__________ 。

已知:(ⅰ)

(ⅱ)
回答下列问题:
(1)A的化学名称是
(2)由B生成C的反应类型是
(3)写出由G生成H的化学方程式:
(4)写出I的结构简式:
(5)X的同分异构体中,符合下列条件的有机物有
ⅰ)只含两种官能团且不含甲基;
ⅱ)含
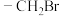 结构,不含C=C=C和环状结构。
结构,不含C=C=C和环状结构。(6)设计由甲苯和
 制备
制备 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
8 . 绿色能源是当今重要的研究热点,2022年3月12日,中科院大连化物所的 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
Ⅰ. 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。
(1)相关的化学键键能数据如下表所示:
Sabatier反应的
__________  。
。
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:__________ (写一点即可)。
(3)在体积为 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
__________ 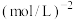 (写计算式)。
(写计算式)。
(4) 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
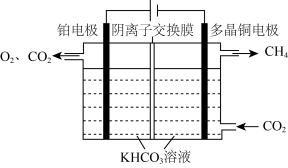
电解过程中,阴极室和阳极室的 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为__________ ;若生成 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为__________ L(标准状况,忽略气体的溶解)。
(5) 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有__________ mol共用电子对,试写出其分子的结构式:__________ 。
 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。Ⅰ.
 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。(1)相关的化学键键能数据如下表所示:
化学键 | H—H | H—O | C—H | C=O |
| 436 | 463 | 413 | 803 |

 。
。(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:
(3)在体积为
 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
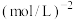 (写计算式)。
(写计算式)。(4)
 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
电解过程中,阴极室和阳极室的
 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为(5)
 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有
您最近一年使用:0次
名校
9 . 氨能与 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。
(1)基态 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ , 中
中 与
与 间形成的化学键为
间形成的化学键为_______ 。
(2)将 置于
置于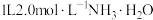 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:
_______ 
_______ 。反应1小时测得溶液中银的总浓度为 ,
, 的溶解速率为
的溶解速率为_______ 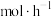 。
。
(3)氨与 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:
(i)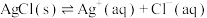
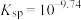
(ii)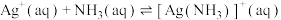
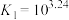
(iii)
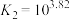
①下列有关说法中,正确的有_______ (填编号)。
A.加少量水稀释,平衡后溶液中 、
、 均减小
均减小
B.随 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大
C.随 增大,
增大, 不变
不变
D.溶液中存在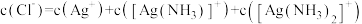
②反应

_______ (用 、
、 、
、 表示)。
表示)。
(4)向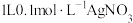 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数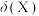 随
随 的变化如图所示。
的变化如图所示。
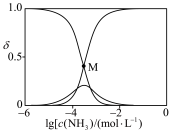
已知溶液中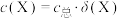 ,
, 。
。
① 点溶液中
点溶液中
_______  。
。
②计算 点溶液中
点溶液中 的转化率
的转化率________ (写出计算过程,已知 )。
)。
 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。(1)基态
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为 中
中 与
与 间形成的化学键为
间形成的化学键为(2)将
 置于
置于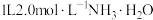 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:

 ,
, 的溶解速率为
的溶解速率为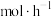 。
。(3)氨与
 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:(i)
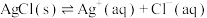
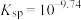
(ii)
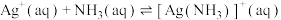
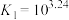
(iii)

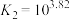
①下列有关说法中,正确的有
A.加少量水稀释,平衡后溶液中
 、
、 均减小
均减小B.随
 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大C.随
 增大,
增大, 不变
不变D.溶液中存在
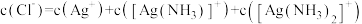
②反应


 、
、 、
、 表示)。
表示)。(4)向
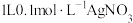 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数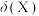 随
随 的变化如图所示。
的变化如图所示。
已知溶液中
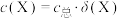 ,
, 。
。①
 点溶液中
点溶液中
 。
。②计算
 点溶液中
点溶液中 的转化率
的转化率 )。
)。
您最近一年使用:0次
2024-04-03更新
|
874次组卷
|
2卷引用:广东省广州市2024届高三下学期一模考试化学试题
解题方法
10 . 绿吉酸是植物体在有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物,具有良好的抗氧化和抗病毒作用。
(1)下列关于莽草酸(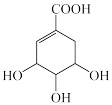 )的说法正确的是
)的说法正确的是
(2)1,2−二氯乙烯( )为无色透明液体,常用作萃取剂、有机合成原料等。
)为无色透明液体,常用作萃取剂、有机合成原料等。
①该物质所含官能团的名称为_______ 。
②下列关于该物质的说法正确的是_______ 。
A.可用于萃取溴水中的溴 B.与 互为同分异构体
互为同分异构体
C.与丙烯互为同系物 D.分子中σ键和π键的个数比为3:1
目前,绿吉酸主要从杜仲科、菊科等植物中提取,某研究人员设计一种合成路线如下。
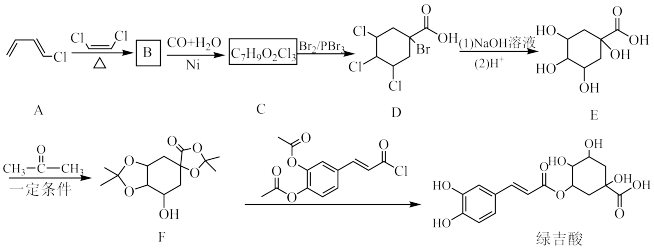
已知:
(3)物质C的结构简式为_______ 。
(4)步骤C→D的反应类型为_______ 。
(5)写出D→E第(1)步的反应式_______ 。
(6)设计E→F步骤的目的是_______ 。
(7)物质F属于
(8)绿吉酸在酸性条件下能发生水解,水解产物有多种同分异构体。写出一种满足下列条件的同分异构体_______ 。(填结构简式)
①含有苯环
②1mol该物质能与2mol NaHCO3反应
③核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1
(9)结合相关信息,设计由2−丁烯和1,3−丁二烯制备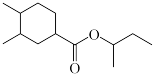 的合成路线
的合成路线_______ 。(无机试剂任选)
(合成路线可表示为: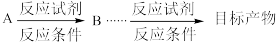 )
)
(1)下列关于莽草酸(
 )的说法正确的是
)的说法正确的是| A.遇FeCl3溶液显紫色 | B.能使酸性高锰酸钾溶液褪色 |
| C.所有碳原子处于同一平面 | D.1 mol莽草酸最多消耗4 mol NaOH |
(2)1,2−二氯乙烯(
 )为无色透明液体,常用作萃取剂、有机合成原料等。
)为无色透明液体,常用作萃取剂、有机合成原料等。①该物质所含官能团的名称为
②下列关于该物质的说法正确的是
A.可用于萃取溴水中的溴 B.与
 互为同分异构体
互为同分异构体C.与丙烯互为同系物 D.分子中σ键和π键的个数比为3:1
目前,绿吉酸主要从杜仲科、菊科等植物中提取,某研究人员设计一种合成路线如下。

已知:
(3)物质C的结构简式为
(4)步骤C→D的反应类型为
(5)写出D→E第(1)步的反应式
(6)设计E→F步骤的目的是
(7)物质F属于
| A.芳香族化合物 | B.链烃 | C.脂环烃 | D.烃的衍生物 |
(8)绿吉酸在酸性条件下能发生水解,水解产物有多种同分异构体。写出一种满足下列条件的同分异构体
①含有苯环
②1mol该物质能与2mol NaHCO3反应
③核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1
(9)结合相关信息,设计由2−丁烯和1,3−丁二烯制备
 的合成路线
的合成路线(合成路线可表示为:
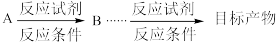 )
)
您最近一年使用:0次