名校
解题方法
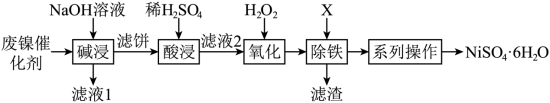
1 . 利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:
(1)为了加快“碱浸”的速率可以采取的措施是_______ (任写两条)。
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____ 。
(3)“滤液2” 中含金属阳离子有_______ 。
(4)①“氧化”中反应的离子反应方程式是_______ 。
②“氧化”中可以代替H2O2的最佳物质是_______ (填标号)。
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的_______ 。
a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_______ 。
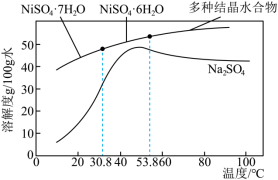
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示。
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于
您最近一年使用:0次
解题方法
2 . 某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径≤2.5um的悬浮颗粒物,已知1μm=1×10-6m),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___________ (填“属于"或“不属于)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为___________ (填“酸”或“碱”)性。
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是___________ (填字母)
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为___________ 。
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___________ 吨(假设生产过程中96%SO2转化为SO3)。
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸
您最近一年使用:0次
解题方法
3 . 按要求回答下列问题:
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有___________ (填字母,下同),属于酸性氧化物的有___________ 。
②Fe2(SO4)3溶于水的电离方程式为___________ 。
③写出实验室制取Fe(OH)3胶体的离子方程式:___________ 。
④写出H与足量A反应的离子方程式:___________ 。
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:___________ 。

②该反应中的还原剂为___________ (填化学式),被还原的物质与被氧化的物质的物质的量之比为___________ 。
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=___________ 。
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有
②Fe2(SO4)3溶于水的电离方程式为
③写出实验室制取Fe(OH)3胶体的离子方程式:
④写出H与足量A反应的离子方程式:
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:

②该反应中的还原剂为
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为
 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=
您最近一年使用:0次
名校
解题方法
4 . 下列离子反应方程式正确的是
A.氯气通入冷的石灰乳: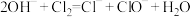 |
B.向NaHCO3溶液中滴入少量澄清石灰水: |
C.向明矾溶液中滴加Ba(OH)2溶液到 恰好完全沉淀时: 恰好完全沉淀时: |
| D.向FeI2溶液中通入少量氯气:Cl2 + 2I- = 2Cl- + I2 |
您最近一年使用:0次
名校
5 . 我国科学家实现了喹啉并内酯的高选择性制备。合成路线如图。
ⅲ.碳碳双键直接与羟基相连不稳定
(1)试剂 为
为_______ ; 中官能团的电子式为
中官能团的电子式为_______ 。
(2) (苯胺)具有碱性,
(苯胺)具有碱性, 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,其原因是
的平衡转化率,其原因是_______ (写出一条即可)。
(3) 的化学方程式为
的化学方程式为_______ 。
(4) 的结构简式为
的结构简式为_______ ; 的反应类型为
的反应类型为_______ 。
(5) 是
是 的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有
的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有_______ 种(不考虑立体异构)。其中核磁共振氢谱有3组峰,峰面积之比为 的结构简式为
的结构简式为_______ 。
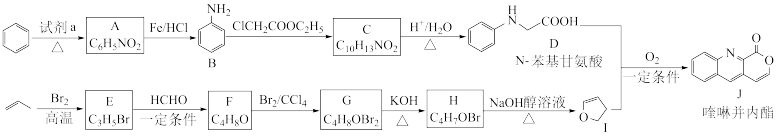
已知:ⅰ.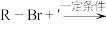
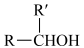

ⅲ.碳碳双键直接与羟基相连不稳定
(1)试剂
 为
为 中官能团的电子式为
中官能团的电子式为(2)
 (苯胺)具有碱性,
(苯胺)具有碱性, 转化为
转化为 的反应中,使
的反应中,使 过量可以提高
过量可以提高 的平衡转化率,其原因是
的平衡转化率,其原因是(3)
 的化学方程式为
的化学方程式为(4)
 的结构简式为
的结构简式为 的反应类型为
的反应类型为(5)
 是
是 的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有
的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有 的结构简式为
的结构简式为
您最近一年使用:0次
名校
解题方法
6 . 以银锰精矿(主要含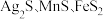 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: 的氧化性强于
的氧化性强于 ;
;
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①“浸锰"过程中,发生反应: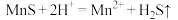 ,则可推断:
,则可推断: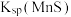
____ (填“ ”或“
”或“ ”)
”)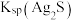 。
。
②在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量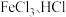 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以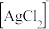 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______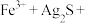 _______
_______ _______
_______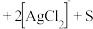 。
。
②结合平衡移动原理,解释浸出剂中 的作用:
的作用:_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有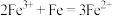 和
和_______ 。
(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图_____ ;基态铁原子核外共有_____ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是_______ 。
③碳与其他元素一起能形成多种酸或酸根。 的空间构型是
的空间构型是_______ 。
④类卤素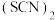 分子中
分子中 键与
键与 键的数目比
键的数目比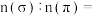
_______ 。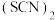 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸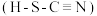 的沸点低于异硫氰酸
的沸点低于异硫氰酸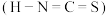 的沸点,其原因是
的沸点,其原因是_______ 。
⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体: 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
_______ pm(写出表达式即可)。
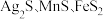 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: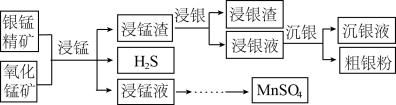
 的氧化性强于
的氧化性强于 ;
;(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①“浸锰"过程中,发生反应:
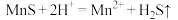 ,则可推断:
,则可推断: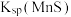
 ”或“
”或“ ”)
”)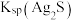 。
。②在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
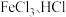 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以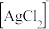 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______
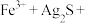 _______
_______ _______
_______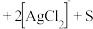 。
。②结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有
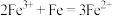 和
和(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是③碳与其他元素一起能形成多种酸或酸根。
 的空间构型是
的空间构型是④类卤素
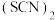 分子中
分子中 键与
键与 键的数目比
键的数目比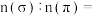
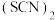 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸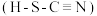 的沸点低于异硫氰酸
的沸点低于异硫氰酸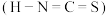 的沸点,其原因是
的沸点,其原因是⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体:
 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
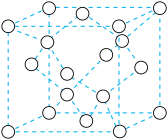
您最近一年使用:0次
名校
7 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠溶液反应):
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是___________ (填序号)。
(2)测定过程中发生反应的离子方程式为:___________ 、___________ 。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
①配制上述的稀盐酸时,需要选取的主要玻璃仪器有酸式滴定管(可量取液体体积精确到0.01mL的仪器)、烧杯、玻璃棒、___________ 。
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是___________ 。
③下列操作会导致配制的盐酸浓度偏低的是___________ 。
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为___________ 。
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为:
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.02 | 13.22 | 12.98 | 13.00 |
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是
③下列操作会导致配制的盐酸浓度偏低的是
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次
解题方法
8 . 甲烷干重整(DRM)是利用 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
Ⅰ.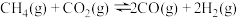
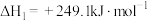
Ⅱ.
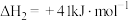
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知 、
、 的摩尔生成焓分别为
的摩尔生成焓分别为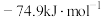 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为_______  。
。
(2)甲烷和二氧化碳的起始物质的量均为 ,实验测得在
,实验测得在 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。_______ mol,反应Ⅱ的压强平衡常数
_______ 。
②为了消除积碳带来的影响,反应选择在_______ (填“高温”或“低温”)下进行。
(3)在不同压强下,按照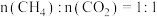 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为________ 。
②压强 、
、 、
、 、
、 由小到大的顺序为
由小到大的顺序为________ 。
③ ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是________ 。
 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:Ⅰ.
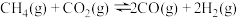
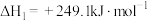
Ⅱ.

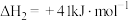
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成
 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知 、
、 的摩尔生成焓分别为
的摩尔生成焓分别为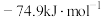 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为 。
。(2)甲烷和二氧化碳的起始物质的量均为
 ,实验测得在
,实验测得在 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。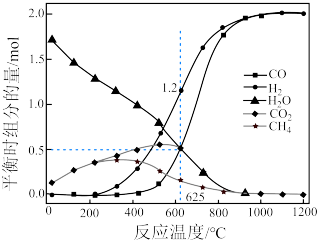

②为了消除积碳带来的影响,反应选择在
(3)在不同压强下,按照
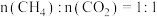 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。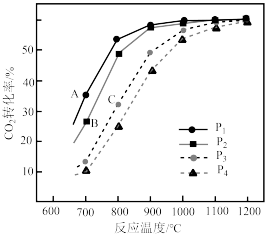
 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为②压强
 、
、 、
、 、
、 由小到大的顺序为
由小到大的顺序为③
 ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是
您最近一年使用:0次
解题方法
9 . 温度为T℃,向体积不等的密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(S)+2NO2(g)=N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。已知:理想气体状态方程是pV=nRT。下列说法错误的是
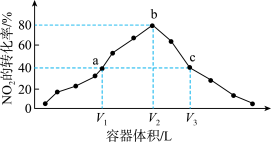
A.T℃时,a点时反应的平衡常数为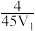 |
| B.根据理想气体方程可知,容器内压强:Pa:Pb=6:7 |
| C.T℃时,b点达到化学平衡状态,c点未达到化学平衡状态 |
| D.对c点容器加压,缩小容器体积,则此时v正>v逆 |
您最近一年使用:0次
10 . 硫脲(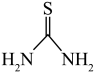 )可用作橡胶的硫化促进剂、金属矿物的浮选剂。测定工业样品中硫脲的质量分数的方法:称取
)可用作橡胶的硫化促进剂、金属矿物的浮选剂。测定工业样品中硫脲的质量分数的方法:称取 g样品,加水溶解配成250mL溶液,取25mL溶液于锥形瓶中,加入稀硫酸酸化,用
g样品,加水溶解配成250mL溶液,取25mL溶液于锥形瓶中,加入稀硫酸酸化,用 酸性
酸性 标准溶液滴定,滴定至终点时消耗标准溶液
标准溶液滴定,滴定至终点时消耗标准溶液 mL[已知滴定时发生反应:
mL[已知滴定时发生反应: ,假设杂质不参与反应]。下列叙述正确的是
,假设杂质不参与反应]。下列叙述正确的是
| A.硫脲中硫元素的化合价为+2 |
| B.滴定时碳、氮元素发生氧化反应 |
C.样品中硫脲的质量分数可表示为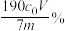 |
| D.若滴定管中滴定前有气泡,滴定后无气泡,会使测定结果偏小 |
您最近一年使用:0次



