解题方法
1 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为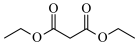 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
(5)已知:R-CN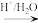 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成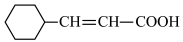 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
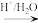 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成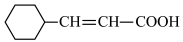 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近一年使用:0次
解题方法
2 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:

(1)证明经步骤①得到的滤液中含有 的方法如下:取样,先滴加
的方法如下:取样,先滴加___________ ,再滴加少量氯水,该过程的现象为___________ 。
(2)步骤②加入氯水发生反应的离子方程式是___________ 。
(3)步骤③产生的红褐色物质成分是___________ (写化学式)。
(4)步骤④中一系列操作为___________ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为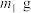 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为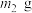 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为___________ (用含 、
、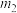 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取1mol ,理论上需要
,理论上需要 物质的量为
物质的量为___________ ,步骤②中反应能够发生的原因是___________ ,分离出 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有___________ 。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)证明经步骤①得到的滤液中含有
 的方法如下:取样,先滴加
的方法如下:取样,先滴加(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
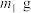 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为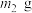 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为 、
、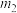 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取1mol
 ,理论上需要
,理论上需要 物质的量为
物质的量为 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有
您最近一年使用:0次
名校
解题方法
3 . 除去粗盐中的Ca2+、Mg2+、 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
您最近一年使用:0次
2024-03-30更新
|
183次组卷
|
63卷引用:山西省大同市天镇县实验中学2020-2021学年高一下学期期中考试化学试题
山西省大同市天镇县实验中学2020-2021学年高一下学期期中考试化学试题山西省阳泉市2022-2023学年高一下学期期末考试化学试题2015-2016学年陕西省城固一中高一上学期期中测试化学试卷山东省昌邑市第一中学2017-2018学年高一上学期期末模拟化学试题吉林省长春外国语学校2017-2018学年高一上学期期末考试化学(文)试题北京市首师附2019-2020学年第一学期期中考试高一化学试卷四川省自贡市田家炳中学2019-2020学年高一上学期期中考试化学试题天津市静海县第一中学2019-2020学年高一3月学生学业能力调研考试化学试题四川省江油中学2018-2019学年高一10月月考化学试题内蒙古北京八中乌兰察布分校2020-2021学年高一上学期第一次月考化学试题北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题宁夏吴忠市吴忠中学2020-2021学年高一上学期期中考试化学试题四川省成都市实验外国语学校(西区)2020-2021学年高一上学期期中考试化学试题山东省日照市莒县2020-2021学年高一11月模块考试化学试题辽宁省抚顺县高级中学2019-2020学年高一下学期期中网课学习质量检测化学试题黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题合肥市第十一中学2020-2021学年高一下学期第一次教学质量评估化学试题贵州省毕节市民族中学2020-2021学年高一上学期12月月考化学试题广东省中山市第二中学2020-2021学年高一下学期第一次段考化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一4月月考化学试题湖北省黄冈市麻城市麻城二中2020-2021学年高一下学期期中考试化学试题河北省师范大学附属中学2020-2021学年高一第二学期期中考试化学试题(已下线)专题01 硫及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)北京市大兴区2020-2021学年高一下学期期末考试化学试题吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题内蒙古集宁新世纪中学2020-2021学年高一上学期期中考试化学试题重庆铁路中学2020-2021学年高一下学期4月月考化学试题广东省2012年全国高中学生化学素质和实验能力竞赛初赛试题(B组)吉林省长春市2020-2021学年高一下学期期末联考化学试题(已下线)3.3.1 粗盐提纯 从海水中提取溴(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)宁夏中卫市第一中学2021-2022学年高一上学期第一次月考化学试题安徽省合肥市第六中学2021-2022学年高一上学期第一次月考化学试题浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题甘肃省永昌县第一高级中学2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高一上学期期末考试化学试题安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题云南省宣威市第三中学2021-2022学年高一下学期4月考试化学试题云南省昆明市云南师范大学附属中学2021-2022学年高一下学期期中考试化学试题山东省临沂市2021-2022学年高一下学期期中考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高一下学期期中考试(选择考)化学试题江苏省天一中学2021-2022学年高一下学期期中考试(文)化学试题北京市东直门中学2021—2022学年高一下学期6月月考化学试题四川省什邡中学2021-2022学年高一上学期第一次月考化学试题云南红河县第一中学2021-2022学年高一下学期期末考试化学试题云南省昆明北大博雅实验中学2020-2021学年高一下学期期中考试化学试题吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题云南省红河县第一中学2020-2021学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高一下学期4月月考(普通班)化学试题湖南省岳阳市2022-2023学年高一上学期第一次月考化学试题辽宁省鞍山市普通高中2022-2023学年高一下学期期中考试化学(A卷)试题广东省广州大同中学2022-2023学年高一下学期期中考试化学试题广东省江门市新会陈经纶中学2022-2023学年高一下学期期中考试(合格考)化学试题安徽省六安第二中学2022-2023学年高一下学期期中考试化学试题陕西省武功县普集高级中学2022-2023学年高一下学期3月月考化学试题广东省佛山市三水中学2022-2023学年高一下学期3月第一次统测化学试题黑龙江省哈尔滨市第四中学校2023-2024学年高一上学期11月月考化学试题 新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高一上学期10月第一次月考化学试卷河北省邯郸市永年区第二中学2023-2024学年高一上学期12月月考化学试题广东省深圳市光明中学2023-2024学年高一下学期3月第一次统测化学试题广东省江门市某校2023-2024学年高一下学期第一次质量检测化学试题安徽省蚌埠市固镇县汉兴学校、怀远县禹泽学校2023-2024学年高一上学期12月期末联考化学试题云南省昆明市禄劝彝族苗族自治县第一中学2023-2024学年高一下学期3月月考化学试题四川省华蓥中学2023-2024学年高一下学期4月月考化学试题
13-14高二下·宁夏银川·期末
4 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: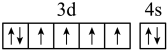 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
219次组卷
|
62卷引用:2015-2016学年山西省大同一中高二下3月月考化学试卷
2015-2016学年山西省大同一中高二下3月月考化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题第一章 本章复习提升1云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
5 . 以废旧锂离子电池(主要成分为 )为原料制备棒状草酸钴晶体(
)为原料制备棒状草酸钴晶体( ,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。
,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。 外,还含
外,还含 、
、 ,
, ,
, ,
, ,
, 等离子;
等离子;
② ,
,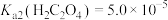 ;
;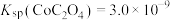 。
。
回答下列问题:
(1)“浸出”时, 与
与 、稀硫酸反应中氧化剂与还原剂的物质的量之比为
、稀硫酸反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)“水解沉淀铝铜”时,沉淀铝反应的离子方程式为___________ 。
(3)沉淀2的成分为 和
和___________ ,“氧化沉淀铁锰”时,生成 的离子方程式为
的离子方程式为___________ 。
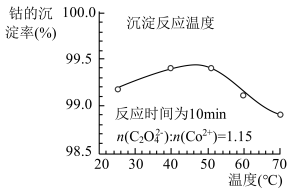
(4)“沉钴”时,温度与钴的沉淀率的关系如图所示,沉淀反应时间为10 min,反应温度为50℃以上时,温度升高,而钴的沉淀率下降,可能原因为___________ 。 溶液代替
溶液代替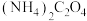 ,反应为
,反应为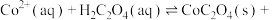
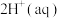 ,则该反应的平衡常数为
,则该反应的平衡常数为___________ ,若平衡时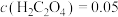 mol⋅L-1,
mol⋅L-1, ,则此时Co2+是否沉淀完全?
,则此时Co2+是否沉淀完全?___________ (填“是”或“否”,离子浓度≤10-5 mol⋅L-1即可认为沉淀完全)。
 )为原料制备棒状草酸钴晶体(
)为原料制备棒状草酸钴晶体( ,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。
,微溶于水,溶解度随温度升高而逐渐增大)的一种方法如下图所示,该法经济可行,为工业化回收废旧锂电池中有色金属提供了依据。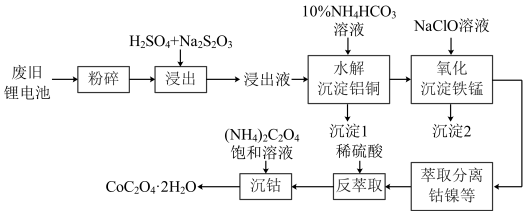
 外,还含
外,还含 、
、 ,
, ,
, ,
, ,
, 等离子;
等离子;②
 ,
,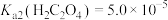 ;
;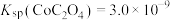 。
。回答下列问题:
(1)“浸出”时,
 与
与 、稀硫酸反应中氧化剂与还原剂的物质的量之比为
、稀硫酸反应中氧化剂与还原剂的物质的量之比为(2)“水解沉淀铝铜”时,沉淀铝反应的离子方程式为
(3)沉淀2的成分为
 和
和 的离子方程式为
的离子方程式为(4)“沉钴”时,温度与钴的沉淀率的关系如图所示,沉淀反应时间为10 min,反应温度为50℃以上时,温度升高,而钴的沉淀率下降,可能原因为
 溶液代替
溶液代替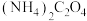 ,反应为
,反应为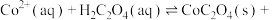
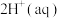 ,则该反应的平衡常数为
,则该反应的平衡常数为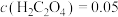 mol⋅L-1,
mol⋅L-1, ,则此时Co2+是否沉淀完全?
,则此时Co2+是否沉淀完全?
您最近一年使用:0次
2024-02-01更新
|
339次组卷
|
2卷引用:山西省忻州市2023-2024学年高三上学期1月期末理综试题-高中化学
名校
解题方法
6 . 过氧化尿素[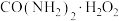 ,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和
,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和 ,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下:
,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下: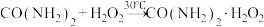 ,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
(1)仪器A的名称是___________ 。
(2)过氧化尿素是过氧化氢和尿素的加合产物,二者之间通过___________ (填“配位键”或“氢键”)相结合。
(3)从抽滤后的母液中分离出 和尿素,可采用的操作是___________(填字母)。
和尿素,可采用的操作是___________(填字母)。
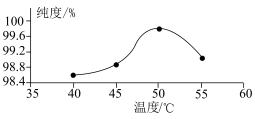
(4)过氧化尿素的纯度与干燥温度的关系如图所示:___________ 。
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 6.0 mol⋅L-1硫酸,然后用0.1000 mol⋅L-1的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:___________ 。
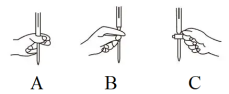
②本实验KMnO4溶液滴定过程中操作滴定管的图示正确的是___________ (填字母)。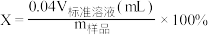 ,根据滴定结果,可确定产品中活性氧的含量为
,根据滴定结果,可确定产品中活性氧的含量为___________ %。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量___________ (填“偏高”“偏低”或“不变”)。
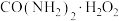 ,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和
,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和 ,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下:
,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下: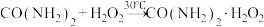 ,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。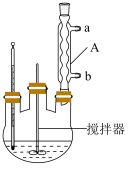
(1)仪器A的名称是
(2)过氧化尿素是过氧化氢和尿素的加合产物,二者之间通过
(3)从抽滤后的母液中分离出
 和尿素,可采用的操作是___________(填字母)。
和尿素,可采用的操作是___________(填字母)。| A.盐析、过滤 | B.减压蒸馏、结晶 | C.分液、过滤 | D.减压蒸馏、萃取 |
(4)过氧化尿素的纯度与干燥温度的关系如图所示:
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 6.0 mol⋅L-1硫酸,然后用0.1000 mol⋅L-1的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:
②本实验KMnO4溶液滴定过程中操作滴定管的图示正确的是
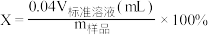 ,根据滴定结果,可确定产品中活性氧的含量为
,根据滴定结果,可确定产品中活性氧的含量为④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
您最近一年使用:0次
2024-02-01更新
|
317次组卷
|
3卷引用:山西省忻州市2023-2024学年高三上学期1月期末理综试题-高中化学
7 . 氨是一种重要的化工产品。回答下列问题:
(1)已知:①N2(g)+3H2(g) 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol
②H2(g)+ O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol
③2Fe(s)+ O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol
则反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=___________ kJ/mol,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=___________ MPa·min-1。
②反应2NH3(g)+Fe2O3(s) N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=___________ (MPa)2 (列出计算式即可);若升高温度,该反应的平衡常数将___________ (填“增大”“减小”或“不变”)。
(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:
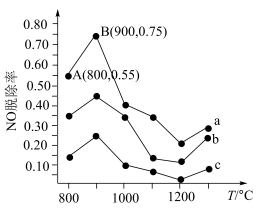
①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是___________ 。
②曲线b对应的NH3与NO的物质的量之比是___________ 。
(1)已知:①N2(g)+3H2(g)
 2NH3(g) ΔH=-92.0kJ/mol
2NH3(g) ΔH=-92.0kJ/mol②H2(g)+
 O2(g)
O2(g) H2O(g) ΔH=-240.0kJ/mol
H2O(g) ΔH=-240.0kJ/mol③2Fe(s)+
 O2(g)
O2(g) Fe2O3(s) ΔH=-1644.0kJ/mol
Fe2O3(s) ΔH=-1644.0kJ/mol则反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s) ΔH=
N2(g)+3H2O(g)+2Fe(s) ΔH=(2)下列关于合成氨工艺的理解中,正确的有___________(填标号)。
| A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率 |
| B.合成氨反应在不同温度下的ΔH和ΔS都小于零 |
| C.NH3易液化,不断将液氨移去,利于反应正向进行 |
| D.原料气中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生 |
(3)温度为T℃,压强恒定为pMPa,用Fe2O3处理NH3和HCN(起始时NH3的体积分数为58%)的混合气体,部分气体的体积分数随时间的变化如图,反应经30min达到平衡。

①0~30min内用NH3的压强变化表示的反应速率v(NH3)=
②反应2NH3(g)+Fe2O3(s)
 N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=
N2(g)+3H2O(g)+2Fe(s)的平衡常数Kp=(4)在催化剂作用下,可用NH3去除NO,其反应原理为4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)分别为4:1、3∶1、1:3时,得到的NO脱除率曲线如图所示:

①曲线a中,在温度超过900℃时,NO脱除率骤然下降的原因可能是
②曲线b对应的NH3与NO的物质的量之比是
您最近一年使用:0次
8 . 三氯化铬是常用的媒染剂和催化剂,易潮解,高温下易被氧气氧化。实验室中用如图所示装置(夹持装置略)制取三氯化铬( 、
、 为气流控制开关)。
为气流控制开关)。

已知:① 气体有毒,能被
气体有毒,能被 溶液吸收,
溶液吸收,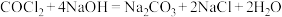 。
。
② 在碱性条件下具有较强还原性,能被
在碱性条件下具有较强还原性,能被 等氧化剂氧化为
等氧化剂氧化为 。
。
③某些物质的颜色、状态、熔点、沸点如下表:
回答下列问题:
(1)制备 的实验步骤如下:
的实验步骤如下:
i.连接装置,检查装置气密性,装入药品,打开 、
、 ,通入
,通入 并通入冷凝水。
并通入冷凝水。
ii.加热管式炉的反应管至 。
。
iii.关闭 (
( 为打开状态),加热
为打开状态),加热 ,温度保持在
,温度保持在 之间。
之间。
iv.加热反应管继续升温至 ,反应所生成的
,反应所生成的 将升华并凝聚在反应管的右端,直到装置
将升华并凝聚在反应管的右端,直到装置 中反应完全,切断管式炉的电源。
中反应完全,切断管式炉的电源。
v.停止加热装置 ,打开
,打开 ,关闭
,关闭 ,继续通入
,继续通入 直至装置
直至装置 中无液滴滴下,停止通入冷凝水。
中无液滴滴下,停止通入冷凝水。
vi.装置冷却后,结束制备实验。
①步骤i中,通 的作用为
的作用为________ 。步骤ⅲ中加热 通常采用的加热方式是
通常采用的加热方式是_________ 。
②步骤iv中装置 中反应完全的标志是
中反应完全的标志是___________ 。
(2)装置 中发生反应的化学方程式为
中发生反应的化学方程式为___________ 。
(3)装置 、
、 的作用是
的作用是___________ 。
(4)准确称取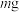 无水三氯化铬样品置于
无水三氯化铬样品置于 烧杯中,加水定容于
烧杯中,加水定容于 容量瓶中。移取
容量瓶中。移取 于
于 碘量瓶中,加热至沸,慢慢加入
碘量瓶中,加热至沸,慢慢加入 (足量),待溶液变成黄色后,再加水至
(足量),待溶液变成黄色后,再加水至 ,充分加热煮沸,冷却后用
,充分加热煮沸,冷却后用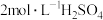 溶液中和至呈橙红色,再加入足量
溶液中和至呈橙红色,再加入足量 溶液,加塞摇匀充分反应后,铬元素只以
溶液,加塞摇匀充分反应后,铬元素只以 存在,暗处静置
存在,暗处静置 后,加入指示剂,用
后,加入指示剂,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (已知杂质不参加反应,且
(已知杂质不参加反应,且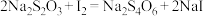 )。
)。
①向碘量瓶中加入 后,发生反应的离子方程式为
后,发生反应的离子方程式为___________ 。
②该样品中无水三氯化铬的质量分数为___________ (用含 、
、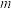 、
、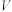 的代数式表示)。
的代数式表示)。
 、
、 为气流控制开关)。
为气流控制开关)。
已知:①
 气体有毒,能被
气体有毒,能被 溶液吸收,
溶液吸收,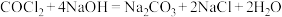 。
。②
 在碱性条件下具有较强还原性,能被
在碱性条件下具有较强还原性,能被 等氧化剂氧化为
等氧化剂氧化为 。
。③某些物质的颜色、状态、熔点、沸点如下表:
| 物质 | 颜色、状态 | 熔点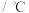 | 沸点/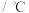 |
 | 绿色晶体 | — | — |
 | 紫色晶体 | — | — |
 | 无色液体 | 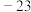 | 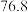 |
(1)制备
 的实验步骤如下:
的实验步骤如下:i.连接装置,检查装置气密性,装入药品,打开
 、
、 ,通入
,通入 并通入冷凝水。
并通入冷凝水。ii.加热管式炉的反应管至
 。
。iii.关闭
 (
( 为打开状态),加热
为打开状态),加热 ,温度保持在
,温度保持在 之间。
之间。iv.加热反应管继续升温至
 ,反应所生成的
,反应所生成的 将升华并凝聚在反应管的右端,直到装置
将升华并凝聚在反应管的右端,直到装置 中反应完全,切断管式炉的电源。
中反应完全,切断管式炉的电源。v.停止加热装置
 ,打开
,打开 ,关闭
,关闭 ,继续通入
,继续通入 直至装置
直至装置 中无液滴滴下,停止通入冷凝水。
中无液滴滴下,停止通入冷凝水。vi.装置冷却后,结束制备实验。
①步骤i中,通
 的作用为
的作用为 通常采用的加热方式是
通常采用的加热方式是②步骤iv中装置
 中反应完全的标志是
中反应完全的标志是(2)装置
 中发生反应的化学方程式为
中发生反应的化学方程式为(3)装置
 、
、 的作用是
的作用是(4)准确称取
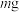 无水三氯化铬样品置于
无水三氯化铬样品置于 烧杯中,加水定容于
烧杯中,加水定容于 容量瓶中。移取
容量瓶中。移取 于
于 碘量瓶中,加热至沸,慢慢加入
碘量瓶中,加热至沸,慢慢加入 (足量),待溶液变成黄色后,再加水至
(足量),待溶液变成黄色后,再加水至 ,充分加热煮沸,冷却后用
,充分加热煮沸,冷却后用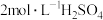 溶液中和至呈橙红色,再加入足量
溶液中和至呈橙红色,再加入足量 溶液,加塞摇匀充分反应后,铬元素只以
溶液,加塞摇匀充分反应后,铬元素只以 存在,暗处静置
存在,暗处静置 后,加入指示剂,用
后,加入指示剂,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (已知杂质不参加反应,且
(已知杂质不参加反应,且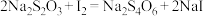 )。
)。①向碘量瓶中加入
 后,发生反应的离子方程式为
后,发生反应的离子方程式为②该样品中无水三氯化铬的质量分数为
 、
、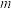 、
、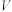 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
9 . 高纯四氧化三锰是电子工业生产锰锌氧软磁材料重要原料之一、以菱锰矿(主要成分为 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“滤渣1”的主要成分为 、
、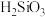 ,还含有
,还含有___________ (填化学式)。
(3)福美钠的化学式为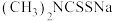 。生成福美镍沉淀的结构为
。生成福美镍沉淀的结构为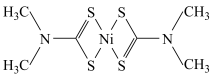 ,其中硫与镍之间的结合方式为下列中的
,其中硫与镍之间的结合方式为下列中的___________ (填标号);
A.离子键 B.金属键 C.氢键 D.配位键
25℃,电离常数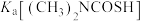
___________  (填“大于”“小于”或“等于”),其判断理由是
(填“大于”“小于”或“等于”),其判断理由是___________ 。
(4)除钙镁时, 、
、 沉淀后溶液中
沉淀后溶液中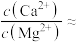
___________ [已知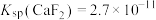 、
、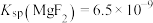 ]
]
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带___________ 电荷(填“正”或“负”)。
(6) 在空气中被氧化生成
在空气中被氧化生成 反应的化学方程式为
反应的化学方程式为___________ 。
(7) 可表示为
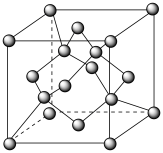
可表示为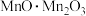 ,温度高于1170℃时属于立方晶体,其中
,温度高于1170℃时属于立方晶体,其中 和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为 ,则晶胞参数
,则晶胞参数
___________ pm(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备四氧化三锰工艺流程如下图所示。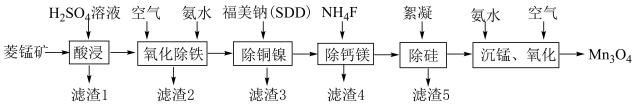
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
 、
、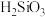 ,还含有
,还含有(3)福美钠的化学式为
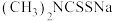 。生成福美镍沉淀的结构为
。生成福美镍沉淀的结构为 ,其中硫与镍之间的结合方式为下列中的
,其中硫与镍之间的结合方式为下列中的A.离子键 B.金属键 C.氢键 D.配位键
25℃,电离常数
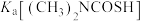
 (填“大于”“小于”或“等于”),其判断理由是
(填“大于”“小于”或“等于”),其判断理由是(4)除钙镁时,
 、
、 沉淀后溶液中
沉淀后溶液中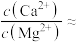
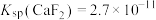 、
、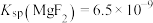 ]
](5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带
(6)
 在空气中被氧化生成
在空气中被氧化生成 反应的化学方程式为
反应的化学方程式为(7)
 可表示为
可表示为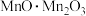 ,温度高于1170℃时属于立方晶体,其中
,温度高于1170℃时属于立方晶体,其中 和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
和Mn3+占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为 ,则晶胞参数
,则晶胞参数
 )。
)。
您最近一年使用:0次
2024-01-06更新
|
639次组卷
|
3卷引用:2024届山西省介休市定阳高级中学高三下学期模拟考试(九)理综试题-高中化学
名校
解题方法
10 . 甘氨酸( )是人体必需氨基酸之一,在25℃时,向
)是人体必需氨基酸之一,在25℃时,向 甘氨酸水溶液中通入HCl或加入NaOH固体,当量随溶液pH变化曲线如图所示。已知:
甘氨酸水溶液中通入HCl或加入NaOH固体,当量随溶液pH变化曲线如图所示。已知: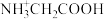 、
、 和
和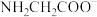 三种形式存在,且有如下平衡:
三种形式存在,且有如下平衡:
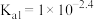 ,
,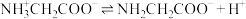
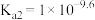 。
。
②在某pH下,溶液中甘氨酸主要以 存在,调pH值使甘氨酸整体所带的正、负电荷数目相等,此时的pH称为该氨基酸的等电点(pI)。
存在,调pH值使甘氨酸整体所带的正、负电荷数目相等,此时的pH称为该氨基酸的等电点(pI)。
下列说法正确的是
 )是人体必需氨基酸之一,在25℃时,向
)是人体必需氨基酸之一,在25℃时,向 甘氨酸水溶液中通入HCl或加入NaOH固体,当量随溶液pH变化曲线如图所示。已知:
甘氨酸水溶液中通入HCl或加入NaOH固体,当量随溶液pH变化曲线如图所示。已知: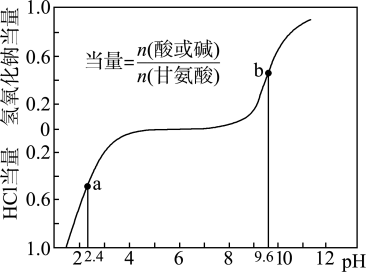
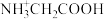 、
、 和
和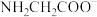 三种形式存在,且有如下平衡:
三种形式存在,且有如下平衡:
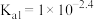 ,
,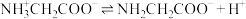
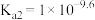 。
。②在某pH下,溶液中甘氨酸主要以
 存在,调pH值使甘氨酸整体所带的正、负电荷数目相等,此时的pH称为该氨基酸的等电点(pI)。
存在,调pH值使甘氨酸整体所带的正、负电荷数目相等,此时的pH称为该氨基酸的等电点(pI)。下列说法正确的是
A.甘氨酸的 |
B. |
C.b点NaOH当量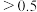 |
D.a点溶液中,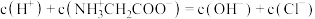 |
您最近一年使用:0次
2024-01-05更新
|
249次组卷
|
5卷引用:山西省运城市新绛县第二中学2023-2024学年高三上学期1月月考理综试题



