解题方法
1 . 25℃时,一定量的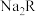 (
( 为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数(
为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数( )与pH的关系如图所示。下列说法错误的是
)与pH的关系如图所示。下列说法错误的是
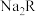 (
( 为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数(
为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数( )与pH的关系如图所示。下列说法错误的是
)与pH的关系如图所示。下列说法错误的是
A.曲线Z表示微粒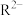 |
B.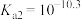 |
C. 时, 时, |
D. 时, 时,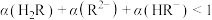 |
您最近一年使用:0次
2 . 设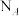 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
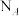 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.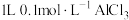 溶液中, 溶液中,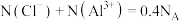 |
B.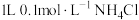 溶液中,所含阳离子总数大于 溶液中,所含阳离子总数大于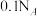 |
C.常温下,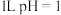 的硫酸溶液中,所含的 的硫酸溶液中,所含的 总数为 总数为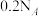 |
D.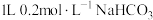 溶液中, 溶液中, |
您最近一年使用:0次
2024-04-25更新
|
24次组卷
|
2卷引用:河南省许平汝名校2023-2024学年高二下学期开学化学试题
名校
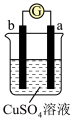
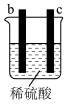
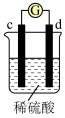
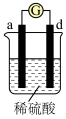
3 . 有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是
| 实验装置 |
|
|
| 部分实验现象 | a极质量减小,b极质量增加 | b极有气体产生,c极无变化 |
| 实验装置 |
|
|
| 部分实验现象 | d极溶解,c极有气体产生 | 电流计指示在导线中电流从a极流向d极 |
A. | B. |
C. | D. |
您最近一年使用:0次
2024-04-21更新
|
207次组卷
|
6卷引用:河南省信阳高级中学2023-2024学年高一下学期4月月考化学试题
河南省信阳高级中学2023-2024学年高一下学期4月月考化学试题湖南省邵东市第一中学2022-2023学年高一上学期期末测试化学试题宁夏石嘴山市第三中学2023-2024学年高一下学期3月月考化学试题(已下线)专题02 化学反应与能量变化-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)广西来宾市忻城县高级中学2023-2024学年高一下学期期中考试化学试卷云南省下关第一中学2023-2024学年高一下学期5月期中考试化学试题
4 . 缓冲溶液是指加少量水稀释或外加少量酸、碱,自身pH不发生显著变化的溶液。1L含1mol乳酸(HLac)和1mol乳酸钠(NaLac)的溶液就是一种缓冲溶液,该溶液的pH为3.85。下图是此缓冲溶液的pH随通入HCl(g)或加入NaOH(s)的物质的量变化的示意图(溶液体积保持1L),已知lg3=0.48。下列说法错误的是
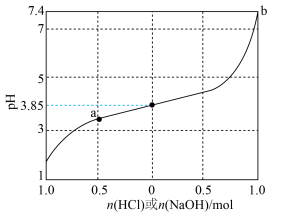
A.此缓冲溶液中(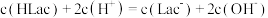 |
| B.通过计算可得出,a点溶液的pH约为3.37 |
| C.根据图像可以判断,b点溶液已失去缓冲能力 |
D.当加入NaOH,且横坐标为0.5时,对应溶液中(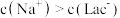 |
您最近一年使用:0次
2024-04-16更新
|
275次组卷
|
4卷引用:2024届河南省济洛平许四市高三下学期第三次质量检测(三模)理综试题-高中化学
名校
5 . 下列有关超分子的说法错误的是
| A.超分子具有“分子识别”和“自组装”的特性 |
| B.分子以共价键聚合形成超分子 |
| C.超分子是由两种或多种分子形成的聚集体 |
| D.分子形成超分子的作用可能是分子间作用力 |
您最近一年使用:0次
2024-04-15更新
|
114次组卷
|
4卷引用:河南省开封市五校2023-2024学年高二上学期期末联考 化学试题
河南省开封市五校2023-2024学年高二上学期期末联考 化学试题(已下线)3.4 配合物与超分子课堂例题(已下线)清单03 晶体结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)辽宁省朝阳市建平县高级中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
6 . 1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
| A.C>D>B>A | B.D>B>A>C | C.A>D>C>B | D.B>A>C>D |
您最近一年使用:0次
2024-04-13更新
|
35次组卷
|
23卷引用:河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题
河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题2015-2016学年贵州省遵义一中高一下第二次联考化学试卷吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题步步为赢 初高中衔接教材化学暑假作业:第1课时 人类对原子结构的认识云南省广南县二中2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律章末综合检测卷湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题江苏省盐城市响水中学2020-2021学年高一上学期期中考试化学试题(已下线)4.1.1 原子结构 元素周期表 核素(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江苏省如皋中学2020-2021学年高一上学期第二次阶段考试化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题甘肃省张掖市2021-2022学年高一上学期期末学业水平质量检测化学试题(已下线)易错专题26 原子的构成-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题第一节 原子结构与元素周期表 第1课时 原子结构 核素山东省菏泽市郓城县第一中学2021-2022学年高一下学期3月阶段性检测化学试题宁夏石嘴山第三中学2021-2022学年高一下学期期末考试化学试题江苏省邳州市宿羊山高级中学2021-2022学年高一上学期第二次学情检测化学试题(已下线)4.1.2 原子核外电子排布规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题北京市第一六六中学2022-2023学年高一上学期期末考试化学试题陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
名校
解题方法
7 . 镁―空气中性燃料电池是一种能被海水激活的电池,其能量比干电池高20~50倍。实验小组以该燃料电池为电源制备 ,工作原理示意图如图所示。下列说法错误的是
,工作原理示意图如图所示。下列说法错误的是
 ,工作原理示意图如图所示。下列说法错误的是
,工作原理示意图如图所示。下列说法错误的是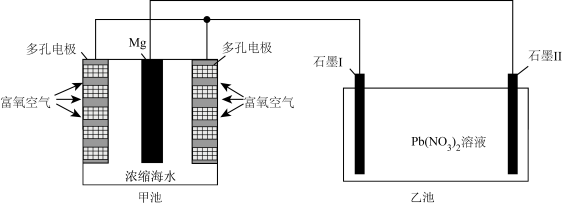
| A.工作时,乙池可能产生导致光化学污染的气体 |
| B.石墨电极Ⅱ增重239g时,外电路中流过2mol电子 |
C.工作时,电源的正极反应式为 |
| D.采用多孔电极有利于增大接触面积便于氧气扩散 |
您最近一年使用:0次
2024-04-07更新
|
741次组卷
|
6卷引用:河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题
河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题河南省许昌高级中学2023-2024学年高三下学期5月月考化学试题云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)题型8 反应热 电化学的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届四川省雅安市天全中学高三下学期模拟预测化学试题
8 . 碘微溶于水,若水中含I﹣,碘溶解度增大,因为存在平衡: 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:
(1)反应 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:
I.将一定质量的单质Ⅰ2完全溶于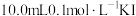 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
Ⅱ.实验测得上层溶液中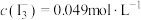 ;
;
Ⅲ.滴定下层溶液至终点时,消耗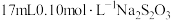 溶液
溶液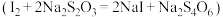 。
。
已知: 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即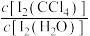 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
①分液时,使用的玻璃仪器有___________ 。
②该条件下反应 的平衡常数K=
的平衡常数K=___________ (保留三位有效数字)。
(2)某废碘液(含有Ⅰ2、 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:
i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为 ;
;
ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、 全部还原为
全部还原为 的实验现象是
的实验现象是___________ 。
②还原和浓缩的顺序不能交换,可能原因是___________ 。
③氧化时发生反应的离子方程式为___________ 。
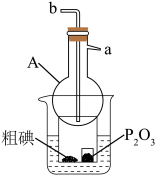
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是___________ ,进水口为___________ (填“a”或“b”),小烧杯中放置P2O5的作用是___________ 。
⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
由此得出的结论是___________ 。
 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:(1)反应
 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:I.将一定质量的单质Ⅰ2完全溶于
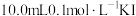 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;Ⅱ.实验测得上层溶液中
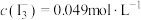 ;
;Ⅲ.滴定下层溶液至终点时,消耗
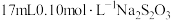 溶液
溶液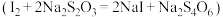 。
。已知:
 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即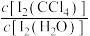 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。①分液时,使用的玻璃仪器有
②该条件下反应
 的平衡常数K=
的平衡常数K=(2)某废碘液(含有Ⅰ2、
 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为
 ;
;ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、
 全部还原为
全部还原为 的实验现象是
的实验现象是②还原和浓缩的顺序不能交换,可能原因是
③氧化时发生反应的离子方程式为
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是

⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
| 比例 | 1:0 | 1:1 | 1:2 | 1:3 | 1:4 | 1:5 |
| 萃取后碘水 | 红 | 浅黄红 | 浅黄 | 浅黄红 | 较浅黄色 | 接近无色 |
您最近一年使用:0次
9 . 元素周期表中某些过渡元素在生产生活中有着广泛的应用,下列说法正确的是
A.Mn可形成 和 和 两种简单离子,稳定性 两种简单离子,稳定性 |
| B.基态Ti原子核外电子的空间运动状态有22种 |
C.基态Cu原子的电子排布式为 |
D.基态 与 与 中未成对的电子数之比为 中未成对的电子数之比为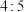 |
您最近一年使用:0次
2024-04-01更新
|
121次组卷
|
2卷引用:河南省信阳市普通高中2023-2024学年高三第二次教学质量检测 化学试题
10 . 氧缺位体(CuFe2O4-δ)是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是(CuFeS2,含Al2O3、SiO2等杂质)、为原料制备CuFe2O4-δ的流程如图:

已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+。
②25℃时已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)Cu位于元素周期表第四周期第______ 族,______ 区。
(2)CuFeS2“焙烧”时生成三种氧化物,其化学方程式为______ 。
(3)加Cu“还原”的目的是_______ 。
(4)滤渣2的主要成分为_______ 。
(5)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间构型是______ 。
(6)充分“煅烧”CuFe2O4得到的氧缺位体(CuFe2O4-δ)的质量为原质量的98%,则δ=______ 。
氧缺位体分解水制氢分两步:
第一步________ (完成方程式);
第二步:2CuFe2O4=2CuFe2O4-δ+δO2↑。
(7)四方晶系CuFeS2晶胞结构如图所示,已知(CuFeS2晶体的密度是ρg•cm-3,则a=______ (设NA为阿伏加德罗常数的值)。


已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+。
②25℃时已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Fe(OH)2 |
| 开始沉淀的pH | 1.9 | 3.4 | 6.4 | 7.0 |
| 完全沉淀的pH | 3.2 | 4.7 | 7.6 | 9.0 |
(1)Cu位于元素周期表第四周期第
(2)CuFeS2“焙烧”时生成三种氧化物,其化学方程式为
(3)加Cu“还原”的目的是
(4)滤渣2的主要成分为
(5)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间构型是
(6)充分“煅烧”CuFe2O4得到的氧缺位体(CuFe2O4-δ)的质量为原质量的98%,则δ=
氧缺位体分解水制氢分两步:
第一步
第二步:2CuFe2O4=2CuFe2O4-δ+δO2↑。
(7)四方晶系CuFeS2晶胞结构如图所示,已知(CuFeS2晶体的密度是ρg•cm-3,则a=

您最近一年使用:0次