名校
解题方法
1 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: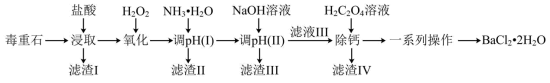
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近一年使用:0次
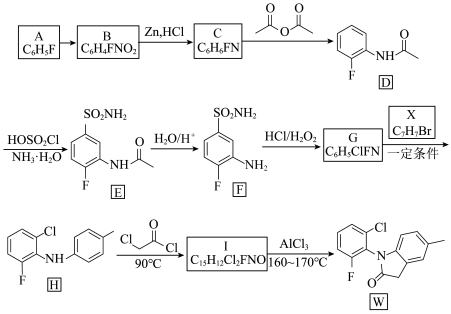
2 . 化合物W是合成风湿性关节炎药物罗美昔布的一种中间体,其合成路线如下:
已知:(ⅰ)
(ⅱ)
回答下列问题:
(1)A的化学名称是__________ ,B中具有的官能团的名称是__________ 。
(2)由B生成C的反应类型是__________ 。
(3)写出由G生成H的化学方程式:__________ 。
(4)写出I的结构简式:__________ 。
(5)X的同分异构体中,符合下列条件的有机物有__________ 种。
ⅰ)只含两种官能团且不含甲基;
ⅱ)含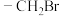 结构,不含C=C=C和环状结构。
结构,不含C=C=C和环状结构。
(6)设计由甲苯和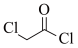 制备
制备 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)__________ 。

已知:(ⅰ)

(ⅱ)
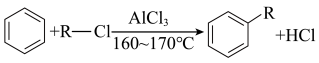
回答下列问题:
(1)A的化学名称是
(2)由B生成C的反应类型是
(3)写出由G生成H的化学方程式:
(4)写出I的结构简式:
(5)X的同分异构体中,符合下列条件的有机物有
ⅰ)只含两种官能团且不含甲基;
ⅱ)含
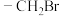 结构,不含C=C=C和环状结构。
结构,不含C=C=C和环状结构。(6)设计由甲苯和
 制备
制备 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
3 . 绿色能源是当今重要的研究热点,2022年3月12日,中科院大连化物所的 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
Ⅰ. 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。
(1)相关的化学键键能数据如下表所示:
Sabatier反应的
__________  。
。
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:__________ (写一点即可)。
(3)在体积为 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
__________ 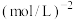 (写计算式)。
(写计算式)。
(4) 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
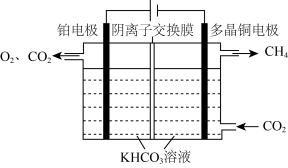
电解过程中,阴极室和阳极室的 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为__________ ;若生成 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为__________ L(标准状况,忽略气体的溶解)。
(5) 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有__________ mol共用电子对,试写出其分子的结构式:__________ 。
 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。Ⅰ.
 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。(1)相关的化学键键能数据如下表所示:
化学键 | H—H | H—O | C—H | C=O |
| 436 | 463 | 413 | 803 |

 。
。(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:
(3)在体积为
 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
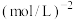 (写计算式)。
(写计算式)。(4)
 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
电解过程中,阴极室和阳极室的
 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为(5)
 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有
您最近一年使用:0次
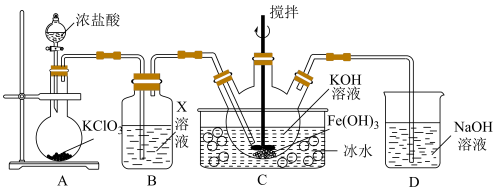
4 . 铁氰化钾 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。
实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。
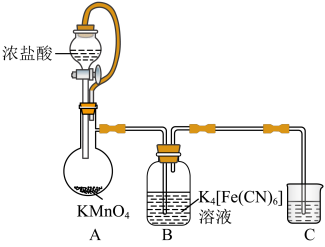
(1)装置A中橡胶管的作用是___________ 。装置C中试剂可能是___________ 。
(2)装置B中化学方程式为___________ 。
(3)从装置B中分离产品,可采用___________ 、降温结晶、___________ 、洗涤、干燥一系列操作。
实验(二)探究 性质。
性质。
【资料显示】
配合物在水中能完全电离出外界和内界,例如: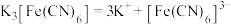 。
。
【提出问题】
 能否电离?
能否电离?
【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
(4)猜想3的横线上应填___________ ,综合上述实验分析,可知:猜想___________ 成立。
(5)用方程式和必要的文字分析实验②现象:___________ ,写出产生蓝色沉淀的离子方程式:___________ 。
 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。

(1)装置A中橡胶管的作用是
(2)装置B中化学方程式为
(3)从装置B中分离产品,可采用
实验(二)探究
 性质。
性质。【资料显示】
配合物在水中能完全电离出外界和内界,例如:
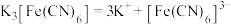 。
。【提出问题】
 能否电离?
能否电离?【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
| 实验 | 实验操作及现象 |
| ① | 向浓度均为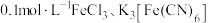 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 |
| ② | 向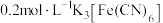 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 |
(4)猜想3的横线上应填
(5)用方程式和必要的文字分析实验②现象:
您最近一年使用:0次
解题方法
5 .  为紫色固体,易溶于水,微溶于
为紫色固体,易溶于水,微溶于 溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
(1)A中发生反应的离子反应方程式是__________ 。
(2)下列试剂中,装置B的X溶液可以选用的是__________(填标号)。
(3)C中得到紫色固体和溶液,生成 的化学方程式是
的化学方程式是__________ ;若要从反应后的装置C中尽可能得到更多的 固体,可以采取的一种措施是
固体,可以采取的一种措施是__________ 。
(4)高铁酸钾与水反应的离子方程式是 (胶体)
(胶体) ,则其作为水处理剂的原理是
,则其作为水处理剂的原理是__________ 、__________ 。
(5)某同学设计如图装置制备一定量的 ,并使其能在较长时间内存在。
,并使其能在较长时间内存在。
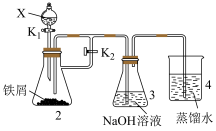
X不能是硝酸,原因是__________ ,装置4的作用是__________ 。
 为紫色固体,易溶于水,微溶于
为紫色固体,易溶于水,微溶于 溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
(1)A中发生反应的离子反应方程式是
(2)下列试剂中,装置B的X溶液可以选用的是__________(填标号)。
| A.饱和食盐水 | B.浓盐酸 | C.饱和氯水 | D. 溶液 溶液 |
(3)C中得到紫色固体和溶液,生成
 的化学方程式是
的化学方程式是 固体,可以采取的一种措施是
固体,可以采取的一种措施是(4)高铁酸钾与水反应的离子方程式是
 (胶体)
(胶体) ,则其作为水处理剂的原理是
,则其作为水处理剂的原理是(5)某同学设计如图装置制备一定量的
 ,并使其能在较长时间内存在。
,并使其能在较长时间内存在。
X不能是硝酸,原因是
您最近一年使用:0次
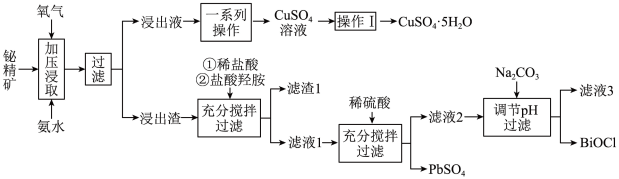
6 . 铋及其化合物在工业生产中用途广泛,如氯氧化铋(BiOCl)常用作电子设备、塑料助剂等。以下是一种用铋精矿(Bi2S3,含有FeS2、Cu2S、PbO2及不溶性杂质)制备BiOCl的一种方法,其流程如图:
① 开始沉淀
开始沉淀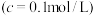 的pH为1.9,沉淀完全
的pH为1.9,沉淀完全 时的pH为3.2。
时的pH为3.2。
② 开始沉淀
开始沉淀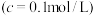 的pH为7.0,沉淀完全
的pH为7.0,沉淀完全 时的pH为9.0。
时的pH为9.0。
③pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:___________ 。
(2)“操作I”为___________ 。基态 的价层电子轨道表示式是
的价层电子轨道表示式是___________ 。
(3)分析盐酸羟胺((NH3OHCl)在流程中的作用是___________ (至少答一点)。
(4)滤液3中 的浓度为0.056g/L,“调pH”步骤中pH的范围为
的浓度为0.056g/L,“调pH”步骤中pH的范围为___________ 。
(5)写出流程中生成BiOCl的离子方程式:___________ 。
(6)铋化锂晶胞结构如图所示: ,B为
,B为___________ 。
②若晶胞的参数为apm,阿伏加德罗常数为 ,晶体的密度计算表达式为
,晶体的密度计算表达式为  。
。
①
 开始沉淀
开始沉淀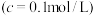 的pH为1.9,沉淀完全
的pH为1.9,沉淀完全 时的pH为3.2。
时的pH为3.2。②
 开始沉淀
开始沉淀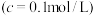 的pH为7.0,沉淀完全
的pH为7.0,沉淀完全 时的pH为9.0。
时的pH为9.0。③pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为
 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:(2)“操作I”为
 的价层电子轨道表示式是
的价层电子轨道表示式是(3)分析盐酸羟胺((NH3OHCl)在流程中的作用是
(4)滤液3中
 的浓度为0.056g/L,“调pH”步骤中pH的范围为
的浓度为0.056g/L,“调pH”步骤中pH的范围为(5)写出流程中生成BiOCl的离子方程式:
(6)铋化锂晶胞结构如图所示:
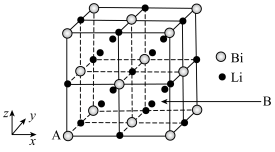
 ,B为
,B为②若晶胞的参数为apm,阿伏加德罗常数为
 ,晶体的密度计算表达式为
,晶体的密度计算表达式为  。
。
您最近一年使用:0次
7 . 现有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1) 的电子式为___________。(A、C为字母代号,请将字母代号用元素符号表示,下同)
的电子式为___________。(A、C为字母代号,请将字母代号用元素符号表示,下同)
(2) 元素的原子核外共有
元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3) 元素原子的
元素原子的 远远大于
远远大于 ,其原因是
,其原因是___________ 。
(4) 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是___________ 。
(5) 位于元素周期表中
位于元素周期表中___________ 区(按电子排布分区),其基态原子的价层电子排布式为___________ 。
(6)G单质投入水中所得溶液阳离子检验方法___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
 元素是形成化合物种类最多的元素 元素是形成化合物种类最多的元素 |
 元素基态原子的核外 元素基态原子的核外 能级电子数比 能级电子数比 能级电子总数少1个 能级电子总数少1个 |
 元素基态原子的核外 元素基态原子的核外 轨道中有两个未成对电子 轨道中有两个未成对电子 |
 元素的气态基态原子的第一至第四电离能分别是 元素的气态基态原子的第一至第四电离能分别是 , , , , , ,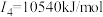 |
 元素的主族序数与周期数的差为4 元素的主族序数与周期数的差为4 |
 元素是前四周期中电负性最小的元素 元素是前四周期中电负性最小的元素 |
 元素位于元素周期表中的第8列 元素位于元素周期表中的第8列 |
 的电子式为___________。(A、C为字母代号,请将字母代号用元素符号表示,下同)
的电子式为___________。(A、C为字母代号,请将字母代号用元素符号表示,下同)(2)
 元素的原子核外共有
元素的原子核外共有(3)
 元素原子的
元素原子的 远远大于
远远大于 ,其原因是
,其原因是(4)
 、
、 、
、 三种元素的简单离子半径由大到小的顺序是
三种元素的简单离子半径由大到小的顺序是(5)
 位于元素周期表中
位于元素周期表中(6)G单质投入水中所得溶液阳离子检验方法
您最近一年使用:0次
2024-03-13更新
|
232次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高二上学期期末考试化学试题
8 . 数字化实验将传感器、数据采集器和计算机相连,采集实验过程中各种物理量变化的数据并记录和呈现,如图采集的用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如图曲线。下列说法错误的是
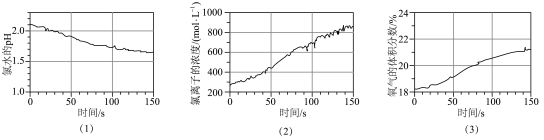
| A.图(1)说明强光照射下,氯水中H+浓度增大 |
| B.结合上图可知,氯水应保存在棕色试剂瓶中,并置于冷暗处 |
C.结合上图可知,若将氯水长时间强光照射,产物为盐酸和 |
| D.结合上图可知,经强光照射一段时间后,氯水的酸性和漂白性均增强 |
您最近一年使用:0次
2024-03-07更新
|
56次组卷
|
3卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
9 . 随着温室效应越来越严重,降低空气中二氧化碳含量成为研究热点,回答下列问题。
将二氧化碳转化为甲醇是目前重要的碳中和方法,体系中发生如下反应:
主反应:①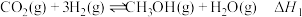
副反应:②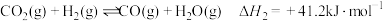
已知: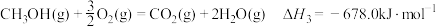

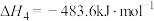
(1)反应①的
___________ (用含 、
、 的代数式表示),该反应在
的代数式表示),该反应在___________ (填“高温”“低温”或“任何温度下”)下有利于自发进行。
(2)密闭容器中通入CO2和H2仅发生反应①,仅改变以下一个条件,能提高H2平衡转化率的措施有___________(填正确答案的编号)。
(3)某温度下,1L恒容密闭容器中加入1molCO2(g)和3molH2(g),发生反应①和反应②,平衡时CO2的转化率为α,CO(g)的物质的量为bmol,计算反应①的平衡常数K=___________ (用含有α、b的计算式表示)。
(4)副反应②在Cu催化时,反应历程如下(*表示吸附在催化剂表面),请写出步骤iv的方程式。
i: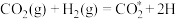
ii: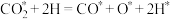
iii:
iv:___________
v: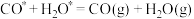
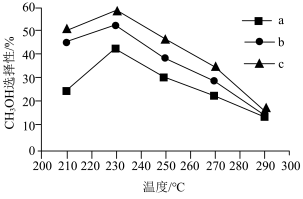
(5)选择不同的温度和催化剂(a、b、c)都对甲醇产率有影响,根据下图,最佳反应条件为___________ 。
(6)电解还原二氧化碳也能实现碳中和,图2为电解还原CO2制备CO,同时获得两种副产物的装置:
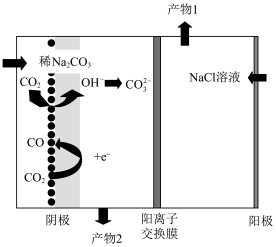
①请写出阳极的电极反应式:___________ 。
②产物2为___________ 。
将二氧化碳转化为甲醇是目前重要的碳中和方法,体系中发生如下反应:
主反应:①
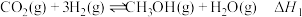
副反应:②
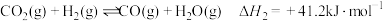
已知:
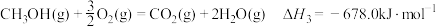

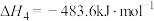
(1)反应①的

 、
、 的代数式表示),该反应在
的代数式表示),该反应在(2)密闭容器中通入CO2和H2仅发生反应①,仅改变以下一个条件,能提高H2平衡转化率的措施有___________(填正确答案的编号)。
| A.恒温恒容时增加CO2(g)用量 | B.恒温恒压下通入惰性气体 |
| C.升高温度 | D.加入催化剂 |
(3)某温度下,1L恒容密闭容器中加入1molCO2(g)和3molH2(g),发生反应①和反应②,平衡时CO2的转化率为α,CO(g)的物质的量为bmol,计算反应①的平衡常数K=
(4)副反应②在Cu催化时,反应历程如下(*表示吸附在催化剂表面),请写出步骤iv的方程式。
i:
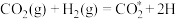
ii:
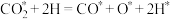
iii:

iv:
v:
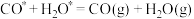
(5)选择不同的温度和催化剂(a、b、c)都对甲醇产率有影响,根据下图,最佳反应条件为

(6)电解还原二氧化碳也能实现碳中和,图2为电解还原CO2制备CO,同时获得两种副产物的装置:

①请写出阳极的电极反应式:
②产物2为
您最近一年使用:0次
名校
10 . 硫代硫酸钠(Na2S2O3)是重要的还原剂,能被酸性KMnO4溶液氧化: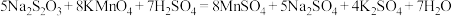 。某学习小组利用含少量杂质的硫代硫酸钠晶体(
。某学习小组利用含少量杂质的硫代硫酸钠晶体( ,
,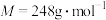 )与0.2500
)与0.2500 酸性KMnO4标准溶液进行深度研究(杂质对反应无影响):
酸性KMnO4标准溶液进行深度研究(杂质对反应无影响):
(1)硫代硫酸钠晶体纯度的分析。
①配制250mLNa2S2O3溶液:称取8.000g硫代硫酸钠晶体,在烧杯中溶解后,转移到___________ (填仪器名称)中,加入蒸馏水稀释至刻度线。
②测定Na2S2O3溶液浓度:取25.00mLNa2S2O3溶液放入锥形瓶中,用酸性KMnO4标准溶液进行滴定,滴定终点的标志是___________ ,测得消耗标准溶液的平均体积为20.00mL,Na2S2O3溶液的浓度为___________  。
。
③由上述实验可得硫代硫酸钠晶体的纯度为___________ %(保留4位有效数字)。
(2)探究外界因素对化学反应速率的影响。控制其他条件相同,取蒸馏水、1.500 稀硫酸、(1)中的Na2S2O3溶液和KMnO4溶液,甲同学设计按下表溶液混合反应,测定每组实验溶液褪色的时间。
稀硫酸、(1)中的Na2S2O3溶液和KMnO4溶液,甲同学设计按下表溶液混合反应,测定每组实验溶液褪色的时间。
①完成上表数据:V1=___________ ,V2=___________ 。
②进行实验,由恰好褪色时间___________ (用a、b、c的大小进行比较)可得出:___________ ,增大反应物浓度,反应速率加快;通过实验___________ (填实验序号)可以分析温度对反应速率的影响。
(3)向少量酸性KMnO4溶液中加入Na2S2O3溶液,用数字传感器测得该反应速率随时间的变化如图,初始阶段反应速率加快的原因可能是___________ (写出一种即可)。

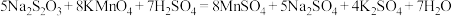 。某学习小组利用含少量杂质的硫代硫酸钠晶体(
。某学习小组利用含少量杂质的硫代硫酸钠晶体( ,
,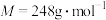 )与0.2500
)与0.2500 酸性KMnO4标准溶液进行深度研究(杂质对反应无影响):
酸性KMnO4标准溶液进行深度研究(杂质对反应无影响):(1)硫代硫酸钠晶体纯度的分析。
①配制250mLNa2S2O3溶液:称取8.000g硫代硫酸钠晶体,在烧杯中溶解后,转移到
②测定Na2S2O3溶液浓度:取25.00mLNa2S2O3溶液放入锥形瓶中,用酸性KMnO4标准溶液进行滴定,滴定终点的标志是
 。
。③由上述实验可得硫代硫酸钠晶体的纯度为
(2)探究外界因素对化学反应速率的影响。控制其他条件相同,取蒸馏水、1.500
 稀硫酸、(1)中的Na2S2O3溶液和KMnO4溶液,甲同学设计按下表溶液混合反应,测定每组实验溶液褪色的时间。
稀硫酸、(1)中的Na2S2O3溶液和KMnO4溶液,甲同学设计按下表溶液混合反应,测定每组实验溶液褪色的时间。| 实验序号 | 温度/℃ | 稀硫酸/mL | 蒸馏水/mL | Na2S2O3溶液/mL | KMnO4溶液/mL | 恰好褪色时间/s |
| 1 | 25 | 5.00 | 0 | 25.00 | 10.00 | a |
| 2 | 25 | 5.00 | 5.00 | 20.00 | V1 | b |
| 3 | 25 | 5.00 | 10.00 | V2 | 10.00 | c |
| 4 | 35 | 5.00 | 10.00 | 15.00 | 10.00 | d |
②进行实验,由恰好褪色时间
(3)向少量酸性KMnO4溶液中加入Na2S2O3溶液,用数字传感器测得该反应速率随时间的变化如图,初始阶段反应速率加快的原因可能是

您最近一年使用:0次




