名校
解题方法
1 . 1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是
| A.C>D>B>A | B.D>B>A>C | C.A>D>C>B | D.B>A>C>D |
您最近一年使用:0次
2024-04-13更新
|
35次组卷
|
23卷引用:广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题
广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题江苏省邳州市宿羊山高级中学2021-2022学年高一上学期第二次学情检测化学试题2015-2016学年贵州省遵义一中高一下第二次联考化学试卷河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题步步为赢 初高中衔接教材化学暑假作业:第1课时 人类对原子结构的认识云南省广南县二中2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律章末综合检测卷湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题江苏省盐城市响水中学2020-2021学年高一上学期期中考试化学试题(已下线)4.1.1 原子结构 元素周期表 核素(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江苏省如皋中学2020-2021学年高一上学期第二次阶段考试化学试题甘肃省张掖市2021-2022学年高一上学期期末学业水平质量检测化学试题(已下线)易错专题26 原子的构成-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)云南省楚雄州民族中学2021-2022学年高一下学期2月开学考试化学试题第一节 原子结构与元素周期表 第1课时 原子结构 核素山东省菏泽市郓城县第一中学2021-2022学年高一下学期3月阶段性检测化学试题宁夏石嘴山第三中学2021-2022学年高一下学期期末考试化学试题(已下线)4.1.2 原子核外电子排布规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)福建省政和县第二中学2022-2023学年高一下学期第一次月考化学试题北京市第一六六中学2022-2023学年高一上学期期末考试化学试题陕西省西安市蓝田县乡镇学校联考2023-2024学年高一上学期1月期末化学试题广西壮族自治区玉林市五校2022-2023学年高二下学期5月联考化学试题
解题方法
2 . 分子式为C9H18O2的有机物A能发生如图的变化:
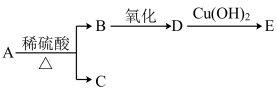
| A.C和E互为同系物 | B.符合题目条件的A共有4种 |
| C.D既能发生氧化反应,又能发生还原反应 | D.符合题目条件的B共有4种 |
您最近一年使用:0次
名校
3 . 氨能与 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。
(1)基态 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ , 中
中 与
与 间形成的化学键为
间形成的化学键为_______ 。
(2)将 置于
置于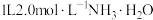 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:
_______ 
_______ 。反应1小时测得溶液中银的总浓度为 ,
, 的溶解速率为
的溶解速率为_______ 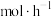 。
。
(3)氨与 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:
(i)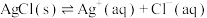
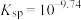
(ii)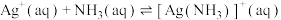
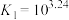
(iii)
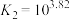
①下列有关说法中,正确的有_______ (填编号)。
A.加少量水稀释,平衡后溶液中 、
、 均减小
均减小
B.随 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大
C.随 增大,
增大, 不变
不变
D.溶液中存在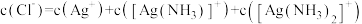
②反应

_______ (用 、
、 、
、 表示)。
表示)。
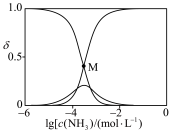
(4)向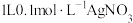 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数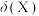 随
随 的变化如图所示。
的变化如图所示。
已知溶液中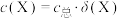 ,
, 。
。
① 点溶液中
点溶液中
_______  。
。
②计算 点溶液中
点溶液中 的转化率
的转化率________ (写出计算过程,已知 )。
)。
 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。(1)基态
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为 中
中 与
与 间形成的化学键为
间形成的化学键为(2)将
 置于
置于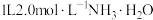 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:

 ,
, 的溶解速率为
的溶解速率为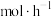 。
。(3)氨与
 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:(i)
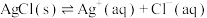
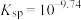
(ii)
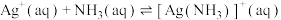
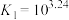
(iii)

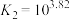
①下列有关说法中,正确的有
A.加少量水稀释,平衡后溶液中
 、
、 均减小
均减小B.随
 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大C.随
 增大,
增大, 不变
不变D.溶液中存在
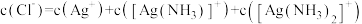
②反应


 、
、 、
、 表示)。
表示)。(4)向
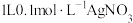 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数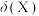 随
随 的变化如图所示。
的变化如图所示。
已知溶液中
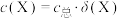 ,
, 。
。①
 点溶液中
点溶液中
 。
。②计算
 点溶液中
点溶液中 的转化率
的转化率 )。
)。
您最近一年使用:0次
2024-04-03更新
|
883次组卷
|
2卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
名校
解题方法
4 . 除去粗盐中的Ca2+、Mg2+、 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
您最近一年使用:0次
2024-03-30更新
|
218次组卷
|
66卷引用:合肥市第十一中学2020-2021学年高一下学期第一次教学质量评估化学试题
合肥市第十一中学2020-2021学年高一下学期第一次教学质量评估化学试题广东省中山市第二中学2020-2021学年高一下学期第一次段考化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一4月月考化学试题湖北省黄冈市麻城市麻城二中2020-2021学年高一下学期期中考试化学试题山西省大同市天镇县实验中学2020-2021学年高一下学期期中考试化学试题河北省师范大学附属中学2020-2021学年高一第二学期期中考试化学试题(已下线)专题01 硫及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)北京市大兴区2020-2021学年高一下学期期末考试化学试题吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题重庆铁路中学2020-2021学年高一下学期4月月考化学试题吉林省长春市2020-2021学年高一下学期期末联考化学试题(已下线)3.3.1 粗盐提纯 从海水中提取溴(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)宁夏中卫市第一中学2021-2022学年高一上学期第一次月考化学试题安徽省合肥市第六中学2021-2022学年高一上学期第一次月考化学试题浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题四川省什邡中学2021-2022学年高一上学期第一次月考化学试题云南省昆明北大博雅实验中学2020-2021学年高一下学期期中考试化学试题云南省红河县第一中学2020-2021学年高一下学期期末考试化学试题2015-2016学年陕西省城固一中高一上学期期中测试化学试卷山东省昌邑市第一中学2017-2018学年高一上学期期末模拟化学试题吉林省长春外国语学校2017-2018学年高一上学期期末考试化学(文)试题北京市首师附2019-2020学年第一学期期中考试高一化学试卷四川省自贡市田家炳中学2019-2020学年高一上学期期中考试化学试题天津市静海县第一中学2019-2020学年高一3月学生学业能力调研考试化学试题四川省江油中学2018-2019学年高一10月月考化学试题内蒙古北京八中乌兰察布分校2020-2021学年高一上学期第一次月考化学试题北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题宁夏吴忠市吴忠中学2020-2021学年高一上学期期中考试化学试题四川省成都市实验外国语学校(西区)2020-2021学年高一上学期期中考试化学试题山东省日照市莒县2020-2021学年高一11月模块考试化学试题辽宁省抚顺县高级中学2019-2020学年高一下学期期中网课学习质量检测化学试题黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题贵州省毕节市民族中学2020-2021学年高一上学期12月月考化学试题内蒙古集宁新世纪中学2020-2021学年高一上学期期中考试化学试题广东省2012年全国高中学生化学素质和实验能力竞赛初赛试题(B组)甘肃省永昌县第一高级中学2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高一上学期期末考试化学试题安徽省蚌埠市2021-2022学年高一上学期期末学业水平测试化学试题云南省宣威市第三中学2021-2022学年高一下学期4月考试化学试题云南省昆明市云南师范大学附属中学2021-2022学年高一下学期期中考试化学试题山东省临沂市2021-2022学年高一下学期期中考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高一下学期期中考试(选择考)化学试题江苏省天一中学2021-2022学年高一下学期期中考试(文)化学试题北京市东直门中学2021—2022学年高一下学期6月月考化学试题云南红河县第一中学2021-2022学年高一下学期期末考试化学试题吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题黑龙江省双鸭山市第一中学2022-2023学年高一下学期4月月考(普通班)化学试题湖南省岳阳市2022-2023学年高一上学期第一次月考化学试题辽宁省鞍山市普通高中2022-2023学年高一下学期期中考试化学(A卷)试题广东省广州大同中学2022-2023学年高一下学期期中考试化学试题广东省江门市新会陈经纶中学2022-2023学年高一下学期期中考试(合格考)化学试题安徽省六安第二中学2022-2023学年高一下学期期中考试化学试题山西省阳泉市2022-2023学年高一下学期期末考试化学试题陕西省武功县普集高级中学2022-2023学年高一下学期3月月考化学试题广东省佛山市三水中学2022-2023学年高一下学期3月第一次统测化学试题黑龙江省哈尔滨市第四中学校2023-2024学年高一上学期11月月考化学试题 新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高一上学期10月第一次月考化学试卷河北省邯郸市永年区第二中学2023-2024学年高一上学期12月月考化学试题广东省深圳市光明中学2023-2024学年高一下学期3月第一次统测化学试题广东省江门市某校2023-2024学年高一下学期第一次质量检测化学试题安徽省蚌埠市固镇县汉兴学校、怀远县禹泽学校2023-2024学年高一上学期12月期末联考化学试题云南省昆明市禄劝彝族苗族自治县第一中学2023-2024学年高一下学期3月月考化学试题四川省华蓥中学2023-2024学年高一下学期4月月考化学试题广东省深圳市龙岗区平湖外国语学校2023-2024学年高一下学期期中考试化学试卷广东省潮州市松昌中学2023-2024学年高一下学期期中考试化学试题重庆市辅仁中学校2023-2024学年高一下学期期中考试化学试题
名校
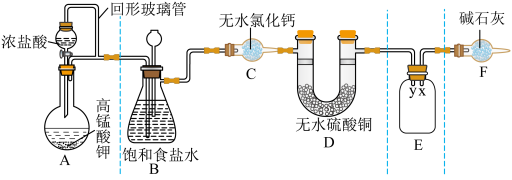
5 . 某同学用 与浓盐酸反应制备纯净的
与浓盐酸反应制备纯净的 的装置如图所示。回答下列问题:
的装置如图所示。回答下列问题:
已知: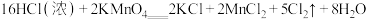
(1)装置A中盛放浓盐酸的仪器名称是
(2)E装置中导管(填“x”或“y”)
(3)装置F的作用有两个:一是
请写出氯气与碱石灰反应的化学方程式
(4)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH(即
三种微粒的物质的量分数随pH(即 )变化的关系如图所示。
)变化的关系如图所示。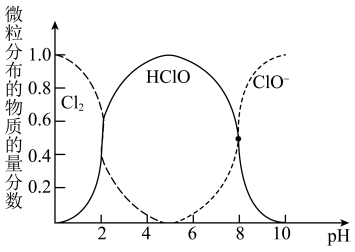
回答问题:①使用84消毒液时为增强消毒效果常调节4<pH<6,原因是
②通常购买的84消毒液pH在12左右,为增强消毒效果可向其中滴加
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(5)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为 ,计算此时所得溶液中NaClO的质量分数为
,计算此时所得溶液中NaClO的质量分数为
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
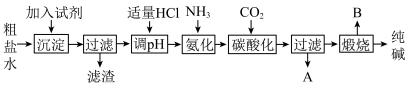
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 下列说法正确的是
| A.2-甲基丁烷与异丁烷互为同分异构体 |
B.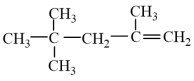 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 |
C.化合物 是苯的同系物 是苯的同系物 |
| D.分子式为C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) |
您最近一年使用:0次
2024-03-18更新
|
363次组卷
|
2卷引用:云南省保山市腾冲市第八中学2021-2022学年高二上学期期末考试化学试题
8 . 磷酸是重要的化学试剂和工业原料。回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(2)已知:
Ⅰ. CaO(s)+H2SO4(l) CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 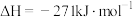
Ⅱ.

①工业上用 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为___________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___________ (填“增大”“减小”“不变”,下同);HF的平衡浓度___________ 。
(3)工业上用磷尾矿制备 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
___________ ,该反应的平衡常数K=___________ 。
②在压强不变的密闭容器中发生上述反应,设起始的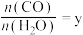 ,CO的平衡体积分数
,CO的平衡体积分数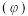 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。

则:该反应的
___________ 0(填“>”“<”或“=”,下同),a___________ 1。
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 |  |  |
| 电离常数 |  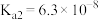 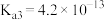 |  |
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(2)已知:
Ⅰ. CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 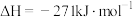
Ⅱ.


①工业上用
 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备
 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和
 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
②在压强不变的密闭容器中发生上述反应,设起始的
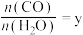 ,CO的平衡体积分数
,CO的平衡体积分数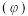 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。
则:该反应的

您最近一年使用:0次
名校
9 . 探究铜和浓硫酸的反应,下列装置或操作错误的是
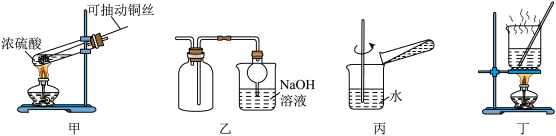
| A.上下移动装置甲中的铜丝体现绿色化学的思想 |
| B.装置乙可用于收集SO2气体 |
| C.将试管中的液体倒入装置丙中稀释,观察颜色可确定CuSO4的生成 |
| D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4∙5H2O |
您最近一年使用:0次
2024-02-27更新
|
1113次组卷
|
16卷引用:人教版2019必修第二册 第五章 第一节 第2课时 硫酸 硫酸根离子的检验
人教版2019必修第二册 第五章 第一节 第2课时 硫酸 硫酸根离子的检验广东省东莞市第五高级中学2020-2021学年高一下学期期中考试化学试题广东省汕头市东方中学2020-2021学年高一下学期期中考试化学试题2016届山东省临沂市高三上学期期中考试化学试卷辽宁省本溪市2019-2020学年高一下学期寒假验收考试化学试题(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测河北省邢台市名校联盟2022-2023学年高一下学期3月月考化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题6-10)四川省成都市郫都区2022-2023学年高一下学期4月期中化学试题第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)湖南省长沙市明德中学2022-2023学年高一下学期5月月考化学试题(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第五章 化工生产中的重要非金属元素【单元测试A卷】江西省宜春市丰城市第九中学2023-2024学年高一下学期期中考试化学试题辽宁省朝阳市建平县实验中学2023-2024学年高一下学期5月期中考试化学试题
21-22高一·全国·课后作业
名校
10 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-02-22更新
|
79次组卷
|
6卷引用:第一章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
(已下线)第一章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)山东省威海市文登新一中2021-2022学年高一上学期12月月考化学试题河北省隆化存瑞中学2022-2023学年高一上学期第一次月考化学试题河南省濮阳市第一高级中学2022-2023学年高一上学期期中质量检测化学试题黑龙江省齐齐哈尔市普高联谊校2022-2023学年高三上学期期中考试化学试题河南省周口市鹿邑县2023-2024学年高一上学期1月期末化学试题



