名校
解题方法
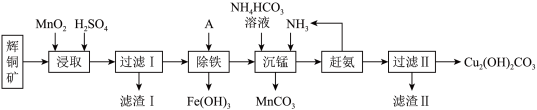
1 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图。
②
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______ 。(任写一种),除铁时溶液的pH值调控范围为:______ 。
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:____________________ 。
(3)常温下“除铁”时加入的试剂A可用______ ,若加A后溶液的pH调为5,则溶液中 的浓度为
的浓度为______  。
。
(4)沉锰的离子方程式为:____________________ 。滤液Ⅱ经蒸发结晶得到的盐主要是______ 。(写化学式)
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是______ 。
金属离子 |
|
|
|
|
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |

(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:
(3)常温下“除铁”时加入的试剂A可用
 的浓度为
的浓度为 。
。(4)沉锰的离子方程式为:
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
2 . 研究碳氧化合物、氮氧化合物、硫氧化合物的处理对缓解环境污染、能源危机具有重要意义。
(1)已知:①碳的燃烧热为393.5
②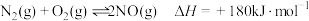
则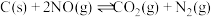 的
的
___________  。
。
(2)用焦炭还原 的反应为:
的反应为: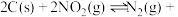
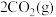 ,向两个容积均为
,向两个容积均为 、反应温度分别为
、反应温度分别为 、
、 的恒温恒容密闭容器中分别加入足量的焦炭和一定量的
的恒温恒容密闭容器中分别加入足量的焦炭和一定量的 ,测得各容器中
,测得各容器中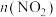 随反应时间
随反应时间 的变化情况如图所示;
的变化情况如图所示;___________ (填“放热”或“吸热”)反应。
② 时,
时,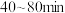 ,用
,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为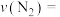
___________ , 时该反应的化学平衡常数
时该反应的化学平衡常数
___________  。
。
③ 下,
下,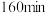 时,向容器中再加入焦炭和
时,向容器中再加入焦炭和 各
各 ,平衡向
,平衡向___________ (填“正”或“逆”)反应方向移动,再次达到平衡后, 的转化率比原平衡
的转化率比原平衡___________ (填“增大”“减小”或“不变”)。
(3)工业上除去氮氧化物的反应为:
①用该法除NO,投料比一定时提高NO平衡转化率的方法有___________ 、___________ 。
②反应温度过高,会发生以下副反应: ;
; ;某科研小组通过系列实验,分析得出脱硝率与氨氮比[
;某科研小组通过系列实验,分析得出脱硝率与氨氮比[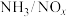 表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是
表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是___________ 。
(1)已知:①碳的燃烧热为393.5

②
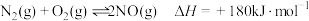
则
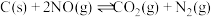 的
的
 。
。(2)用焦炭还原
 的反应为:
的反应为: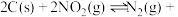
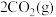 ,向两个容积均为
,向两个容积均为 、反应温度分别为
、反应温度分别为 、
、 的恒温恒容密闭容器中分别加入足量的焦炭和一定量的
的恒温恒容密闭容器中分别加入足量的焦炭和一定量的 ,测得各容器中
,测得各容器中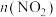 随反应时间
随反应时间 的变化情况如图所示;
的变化情况如图所示;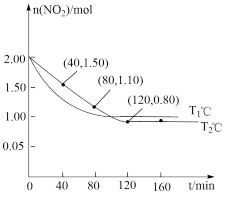
②
 时,
时,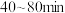 ,用
,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为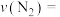
 时该反应的化学平衡常数
时该反应的化学平衡常数
 。
。③
 下,
下,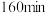 时,向容器中再加入焦炭和
时,向容器中再加入焦炭和 各
各 ,平衡向
,平衡向 的转化率比原平衡
的转化率比原平衡(3)工业上除去氮氧化物的反应为:

①用该法除NO,投料比一定时提高NO平衡转化率的方法有
②反应温度过高,会发生以下副反应:
 ;
; ;某科研小组通过系列实验,分析得出脱硝率与氨氮比[
;某科研小组通过系列实验,分析得出脱硝率与氨氮比[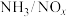 表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是
表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是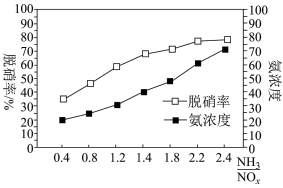
您最近一年使用:0次
名校
解题方法
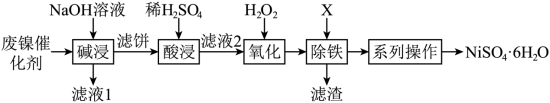
3 . 利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:
(1)为了加快“碱浸”的速率可以采取的措施是_______ (任写两条)。
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____ 。
(3)“滤液2” 中含金属阳离子有_______ 。
(4)①“氧化”中反应的离子反应方程式是_______ 。
②“氧化”中可以代替H2O2的最佳物质是_______ (填标号)。
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的_______ 。
a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_______ 。
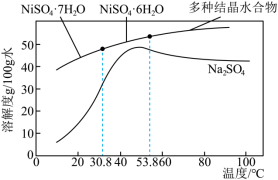
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示。
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于
您最近一年使用:0次
解题方法
4 . 某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径≤2.5um的悬浮颗粒物,已知1μm=1×10-6m),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___________ (填“属于"或“不属于)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为___________ (填“酸”或“碱”)性。
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是___________ (填字母)
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为___________ 。
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___________ 吨(假设生产过程中96%SO2转化为SO3)。
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(4)硫酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸
您最近一年使用:0次
解题方法
5 . 按要求回答下列问题:
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有___________ (填字母,下同),属于酸性氧化物的有___________ 。
②Fe2(SO4)3溶于水的电离方程式为___________ 。
③写出实验室制取Fe(OH)3胶体的离子方程式:___________ 。
④写出H与足量A反应的离子方程式:___________ 。
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:___________ 。

②该反应中的还原剂为___________ (填化学式),被还原的物质与被氧化的物质的物质的量之比为___________ 。
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=___________ 。
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有
②Fe2(SO4)3溶于水的电离方程式为
③写出实验室制取Fe(OH)3胶体的离子方程式:
④写出H与足量A反应的离子方程式:
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:

②该反应中的还原剂为
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为
 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=
您最近一年使用:0次
名校
解题方法
6 . 氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠( ),能消除人体内的活性氧,由此推断
),能消除人体内的活性氧,由此推断 的作用是作
的作用是作______ (填“氧化剂”或“还原剂”)。
(2)高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。请双线桥法标出上述反应中电子转移的方向和数目:
。请双线桥法标出上述反应中电子转移的方向和数目:____________ 。
(3) 是一种常用的消毒剂,工业上制备
是一种常用的消毒剂,工业上制备 的反应:
的反应: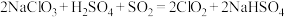
①氧化剂和还原剂的质量之比是____________ 。
②请用单线桥法标出上述反应电子转移的方向和数目:____________ 。
(4) 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
①从 氧元素的化合价可推测,
氧元素的化合价可推测, 既具有
既具有______ 性,又具有______ 性。
② 被称为“绿色氧化剂”的理由是
被称为“绿色氧化剂”的理由是____________ 。
③已知反应物和生成物共有六种粒子: 、
、 、
、 、
、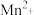 、
、 、
、 。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为
。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为____________ 。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(
 ),能消除人体内的活性氧,由此推断
),能消除人体内的活性氧,由此推断 的作用是作
的作用是作(2)高铁酸钠(
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。请双线桥法标出上述反应中电子转移的方向和数目:
。请双线桥法标出上述反应中电子转移的方向和数目:(3)
 是一种常用的消毒剂,工业上制备
是一种常用的消毒剂,工业上制备 的反应:
的反应: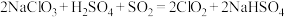
①氧化剂和还原剂的质量之比是
②请用单线桥法标出上述反应电子转移的方向和数目:
(4)
 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
可作为矿业废液消毒剂,有“绿色氧化剂”的美称。①从
 氧元素的化合价可推测,
氧元素的化合价可推测, 既具有
既具有②
 被称为“绿色氧化剂”的理由是
被称为“绿色氧化剂”的理由是③已知反应物和生成物共有六种粒子:
 、
、 、
、 、
、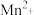 、
、 、
、 。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为
。反应后溶液紫红色褪去,并有气泡产生。则该反应的离子方程式为
您最近一年使用:0次
名校
7 . 目前工业上可用 来生产燃料甲醇,某温度下,向体积为
来生产燃料甲醇,某温度下,向体积为 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和 ,
, 后达到化学平衡状态,此时
后达到化学平衡状态,此时 的平衡转化率为
的平衡转化率为 ,下图表示该反应进行过程中能量的变化:
,下图表示该反应进行过程中能量的变化: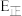
________  (填“>”、“<”或“=”),其中
(填“>”、“<”或“=”),其中 、
、 两种途径反应速率较快的是
两种途径反应速率较快的是________ (填“ ”或“
”或“ ”,该反应的热化学方程式为
”,该反应的热化学方程式为________ ,该反应的平衡常数表达式为:________ 。
(2)从反应开始到平衡,用 的浓度变化表示平均反应速率
的浓度变化表示平均反应速率
________ 。
(3)反应过程中,下列能说明该反应达到平衡状态的是________ (填字母)。
A.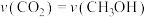 B.混合气体的密度保持不变
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.体系压强保持不变
E. F.每生成
F.每生成 的同时生成
的同时生成
(4)工业上也可用 生产甲醇。在一容积可变的密闭容器中充入
生产甲醇。在一容积可变的密闭容器中充入 与
与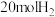 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: ,
, 的平衡转化率
的平衡转化率 与温度
与温度 、压强
、压强 的关系如图所示:
的关系如图所示: 、
、 、
、 三点条件下的平衡常数
三点条件下的平衡常数 、
、 和
和 由大到小的顺序为:
由大到小的顺序为:________ 。
(5)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示:________ 。
 来生产燃料甲醇,某温度下,向体积为
来生产燃料甲醇,某温度下,向体积为 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和 ,
, 后达到化学平衡状态,此时
后达到化学平衡状态,此时 的平衡转化率为
的平衡转化率为 ,下图表示该反应进行过程中能量的变化:
,下图表示该反应进行过程中能量的变化: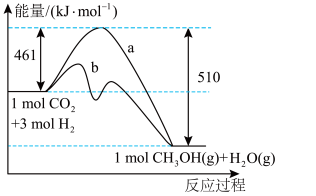
 (填“>”、“<”或“=”),其中
(填“>”、“<”或“=”),其中 、
、 两种途径反应速率较快的是
两种途径反应速率较快的是 ”或“
”或“ ”,该反应的热化学方程式为
”,该反应的热化学方程式为(2)从反应开始到平衡,用
 的浓度变化表示平均反应速率
的浓度变化表示平均反应速率
(3)反应过程中,下列能说明该反应达到平衡状态的是
A.
 B.混合气体的密度保持不变
B.混合气体的密度保持不变C.混合气体的平均相对分子质量保持不变 D.体系压强保持不变
E.
 F.每生成
F.每生成 的同时生成
的同时生成
(4)工业上也可用
 生产甲醇。在一容积可变的密闭容器中充入
生产甲醇。在一容积可变的密闭容器中充入 与
与 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: ,
, 的平衡转化率
的平衡转化率 与温度
与温度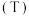 、压强
、压强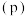 的关系如图所示:
的关系如图所示: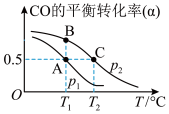
 、
、 、
、 三点条件下的平衡常数
三点条件下的平衡常数 、
、 和
和 由大到小的顺序为:
由大到小的顺序为:(5)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示:

您最近一年使用:0次
8 . 氢气的制备是氢能可否有效推广的关键所在。
I.甲醇水蒸气催化重整是当前制取氢气的主要方法,反应为: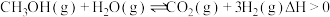 ,回答下列问题:
,回答下列问题:
(1)在催化剂作用下可通过三个基元反应实现催化重整,能量变化如图所示,则
________  (用含字母
(用含字母 、
、 、
、 的代数式表示)。
的代数式表示)。 甲醇气体和
甲醇气体和 水蒸气混合充入
水蒸气混合充入 恒容密闭容器中,控制反应温度为
恒容密闭容器中,控制反应温度为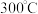 、起始压强为
、起始压强为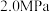 下进行反应,存在副反应:
下进行反应,存在副反应: ,平衡时容器中
,平衡时容器中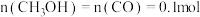 ,此时
,此时 的浓度为
的浓度为_______ 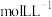 ,甲醇的转化率为
,甲醇的转化率为________ 。
II.高温分解 也可以得到氢气,
也可以得到氢气,
(3)在恒温恒压条件下,对于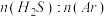 分别为
分别为 、
、 、
、 、
、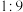 、
、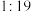 的
的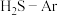 混合气,发生热分解反应过程中
混合气,发生热分解反应过程中 转化率随时间的变化如图所示,其中,
转化率随时间的变化如图所示,其中,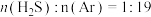 时对应图中曲线
时对应图中曲线________ (填字母)。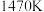 ,
,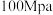 条件下,在
条件下,在 恒压容器中充入
恒压容器中充入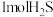 和
和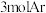 进行
进行 热分解反应,
热分解反应, 后达到平衡,混合气体中
后达到平衡,混合气体中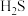 与
与 的体积分数相等,则平衡常数
的体积分数相等,则平衡常数
________ 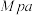 。(计算结果保留一位小数)
。(计算结果保留一位小数)
I.甲醇水蒸气催化重整是当前制取氢气的主要方法,反应为:
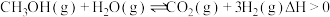 ,回答下列问题:
,回答下列问题:(1)在催化剂作用下可通过三个基元反应实现催化重整,能量变化如图所示,则

 (用含字母
(用含字母 、
、 、
、 的代数式表示)。
的代数式表示)。
 甲醇气体和
甲醇气体和 水蒸气混合充入
水蒸气混合充入 恒容密闭容器中,控制反应温度为
恒容密闭容器中,控制反应温度为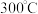 、起始压强为
、起始压强为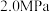 下进行反应,存在副反应:
下进行反应,存在副反应: ,平衡时容器中
,平衡时容器中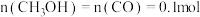 ,此时
,此时 的浓度为
的浓度为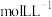 ,甲醇的转化率为
,甲醇的转化率为II.高温分解
 也可以得到氢气,
也可以得到氢气,
(3)在恒温恒压条件下,对于
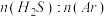 分别为
分别为 、
、 、
、 、
、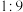 、
、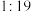 的
的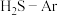 混合气,发生热分解反应过程中
混合气,发生热分解反应过程中 转化率随时间的变化如图所示,其中,
转化率随时间的变化如图所示,其中,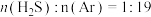 时对应图中曲线
时对应图中曲线
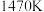 ,
,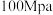 条件下,在
条件下,在 恒压容器中充入
恒压容器中充入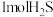 和
和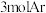 进行
进行 热分解反应,
热分解反应, 后达到平衡,混合气体中
后达到平衡,混合气体中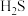 与
与 的体积分数相等,则平衡常数
的体积分数相等,则平衡常数
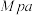 。(计算结果保留一位小数)
。(计算结果保留一位小数)
您最近一年使用:0次
9 . 氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)298K时,1g 燃烧生成
燃烧生成 放热120.9kJ,1mol
放热120.9kJ,1mol 蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为______ 。
(2)碱性(电解质为KOH溶液)氢氧燃料电池中负极电极反应式为______ 。
(3)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.
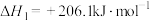
Ⅱ.
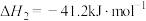
①下列措施中,不能提高 平衡转化率的是
平衡转化率的是______ (填标号)。
A.增加 用量 B.增加
用量 B.增加 用量
用量
C.恒温恒压下通入惰性气体 D.加入催化剂
②恒温恒压条件下,1mol 和1mol
和1mol 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为b mol。其他条件不变,
的物质的量为b mol。其他条件不变, 起始量增加到4mol,达平衡时,
起始量增加到4mol,达平衡时,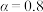 ,
,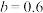 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为______ (结果保留3位有效数字,下同),该条件下,反应Ⅱ的化学平衡常数
______ 。
③“碳达峰·碳中和”是我国社会发展重大战略之一, 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应为:
是实现“双碳”经济的有效途径之一,相关的主要反应为:

______ 。
(4)氢气还是合成氨工业的原料气,其反应为:

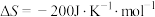 。该反应在常温下
。该反应在常温下______ (填“能”或“不能”)自发。
(1)298K时,1g
 燃烧生成
燃烧生成 放热120.9kJ,1mol
放热120.9kJ,1mol 蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)碱性(电解质为KOH溶液)氢氧燃料电池中负极电极反应式为
(3)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.

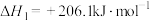
Ⅱ.

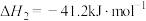
①下列措施中,不能提高
 平衡转化率的是
平衡转化率的是A.增加
 用量 B.增加
用量 B.增加 用量
用量C.恒温恒压下通入惰性气体 D.加入催化剂
②恒温恒压条件下,1mol
 和1mol
和1mol 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为b mol。其他条件不变,
的物质的量为b mol。其他条件不变, 起始量增加到4mol,达平衡时,
起始量增加到4mol,达平衡时,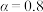 ,
,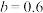 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为
③“碳达峰·碳中和”是我国社会发展重大战略之一,
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应为:
是实现“双碳”经济的有效途径之一,相关的主要反应为:

(4)氢气还是合成氨工业的原料气,其反应为:


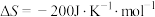 。该反应在常温下
。该反应在常温下
您最近一年使用:0次
解题方法
10 . 读下图信息,下列说法错误的是
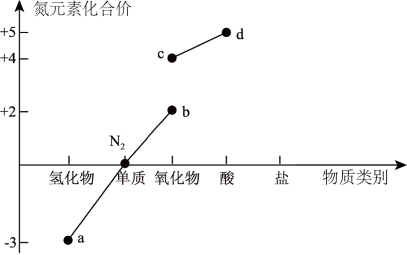
| A.a可经催化氧化生成b |
| B.b、c均为大气污染气体,在空气中可稳定存在 |
| C.Cu与d的浓溶液常温下反应可生成c |
| D.d的浓溶液保存在棕色试剂瓶中并放置在阴凉处 |
您最近一年使用:0次






