解题方法
1 . 钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2•6H2O粗品的工艺流程图如下:
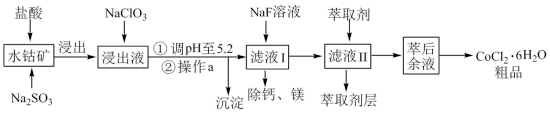
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的 如下表:
如下表:
请回答下列问题:
(1)上述工艺流程图中操作a的名称为___________ 。
(2)Co的价电子排布式________________ 。
(3)写出“浸出”时Co2O3发生反应的离子方程式:___________ 。
(4)加入 的作用是
的作用是___________ 。
(5)萃取剂对金属离子的萃取率与 关系如图。使用萃取剂最适宜的
关系如图。使用萃取剂最适宜的
______ (填字母)。

已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的
 如下表:
如下表:| 沉淀物 |  |  |  |  |  |
开始沉淀时的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀时的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)上述工艺流程图中操作a的名称为
(2)Co的价电子排布式
(3)写出“浸出”时Co2O3发生反应的离子方程式:
(4)加入
 的作用是
的作用是(5)萃取剂对金属离子的萃取率与
 关系如图。使用萃取剂最适宜的
关系如图。使用萃取剂最适宜的
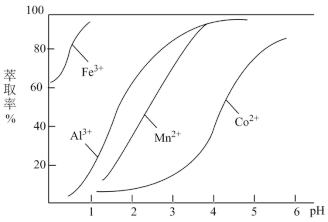
A.接近2.0 B.接近3.0 C.接近5.0
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上用CO为原料生产燃料甲醇,一定条件下发生反应
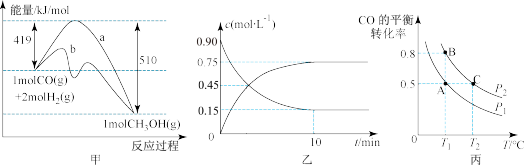
(1)由图甲可知该反应使用催化剂的途径是___________ (填写“a”或“b”),反应的热化学方程式是___________ 。
(2)图乙是反应 中部分物质的浓度随时间t的变化情况,
中部分物质的浓度随时间t的变化情况, 内,用
内,用 表示的平均反应速率
表示的平均反应速率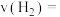
___________
(3)容积可变的密闭容器中充入 和
和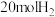 ,发生反应
,发生反应 ,
, 的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。
的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。
①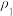
___________ 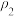 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②比较图丙中A、B、C三点平衡常数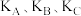 的大小:
的大小:___________ (从大到小排列)。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数
___________ 。
Ⅱ.根据表中数据回答问题:
表1:25℃时浓度为 两种溶液的
两种溶液的
表2:25℃时两种酸的电离平衡常数
(4)①根据表1能不能判断出 与
与 的酸性强弱?
的酸性强弱?___________ (填“能”或“不能”)。
② 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为___________
③ 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为___________
(5)已知:t℃时, 为白色沉淀,
为白色沉淀, 为砖红色沉淀,在
为砖红色沉淀,在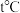 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为
溶液至过量且不断搅拌,实验现象为___________ 。
工业上用CO为原料生产燃料甲醇,一定条件下发生反应

(1)由图甲可知该反应使用催化剂的途径是

(2)图乙是反应
 中部分物质的浓度随时间t的变化情况,
中部分物质的浓度随时间t的变化情况, 内,用
内,用 表示的平均反应速率
表示的平均反应速率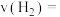
(3)容积可变的密闭容器中充入
 和
和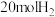 ,发生反应
,发生反应 ,
, 的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。
的平衡转化率随温度(T)、压强(ρ)的变化如图丙所示。①
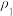
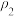 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②比较图丙中A、B、C三点平衡常数
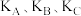 的大小:
的大小:③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数

Ⅱ.根据表中数据回答问题:
表1:25℃时浓度为
 两种溶液的
两种溶液的
| 溶质 |  |  |
 | 9.7 | 11.6 |
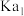 | 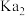 | |
 | 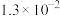 | 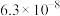 |
 | 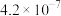 | 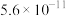 |
(4)①根据表1能不能判断出
 与
与 的酸性强弱?
的酸性强弱?②
 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为③
 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为(5)已知:t℃时,
 为白色沉淀,
为白色沉淀, 为砖红色沉淀,在
为砖红色沉淀,在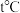 时,向
时,向 和
和 浓度均为
浓度均为 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液至过量且不断搅拌,实验现象为
溶液至过量且不断搅拌,实验现象为
您最近一年使用:0次
2024-01-21更新
|
336次组卷
|
2卷引用:广西柳州铁一中学2023-2024学年高二上学期10月校际交流联考化学试卷
3 . 酸性矿山废水中锌、铁、锰元素的分离及回收流程如图:

已知:①酸性矿山废水成分如表:
②
③
(1)“研磨”的目的是___________ 。
(2)“沉锌”过程中, 先转化为
先转化为 和
和 ,所得
,所得
___________ 。
(3)“沉锌”过程中,完全沉淀时[c(Zn2+)≤10-5mol/L],测得溶液 为4,则
为4,则
___________  。
。
(4)“氧化”过程发生反应的离子方程式为___________ 。
(5)“沉铁”过程中,加入 调节
调节 ,废水
,废水 对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水
对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水 控制
控制___________ 。

(6)“沉锰”后,溶液中 ,锰元素去除率为
,锰元素去除率为___________ %。 (保留1位小数,忽略体积变化)。

已知:①酸性矿山废水成分如表:
| pH | 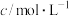 | ||
 |  |  | |
| 1.0 |  |  | 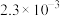 |

③

(1)“研磨”的目的是
(2)“沉锌”过程中,
 先转化为
先转化为 和
和 ,所得
,所得
(3)“沉锌”过程中,完全沉淀时[c(Zn2+)≤10-5mol/L],测得溶液
 为4,则
为4,则
 。
。(4)“氧化”过程发生反应的离子方程式为
(5)“沉铁”过程中,加入
 调节
调节 ,废水
,废水 对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水
对铁、锰元素去除率的影响如图所示,为提高铁、锰元素的分离效果,废水 控制
控制
(6)“沉锰”后,溶液中
 ,锰元素去除率为
,锰元素去除率为
您最近一年使用:0次
名校
4 . 碳酸锰可作为陶瓷、涂料和清漆的原料,氧化铜是玻璃、搪瓷、陶瓷等工业的着色剂。一种利用铜矿(主要成分是CuS,含杂质FeS、 )、软锰矿(主要成分是
)、软锰矿(主要成分是 ,含杂质
,含杂质 、
、 )联合制备
)联合制备 、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
、CuO的工艺流程如下(软锰矿相对铜矿稍过量):

常温下,有关金属离子形成氢氧化物沉淀的pH见下表:
回答下列问题:
(1)“滤渣a”中含硫单质,还含有_______ (填化学式)。
(2)已知 的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:
的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:_______ 。软锰矿稍过量的主要目的是_______ 。
(3)除铁铝操作控制溶液的pH最小为_______ ,常需要加热煮沸的目的是_______ 。
(4)“沉锰”中生成 的离子方程式为
的离子方程式为_______ 。
(5)实验室对 沉淀进行洗涤的操作是
沉淀进行洗涤的操作是_______ 。
(6)“蒸氨”所得气体为混合物,则其成分是_______ (填化学式)。
 )、软锰矿(主要成分是
)、软锰矿(主要成分是 ,含杂质
,含杂质 、
、 )联合制备
)联合制备 、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
、CuO的工艺流程如下(软锰矿相对铜矿稍过量):
常温下,有关金属离子形成氢氧化物沉淀的pH见下表:
| 金属离子 |  |  |  |  |  |
| 开始沉淀时的pH | 7.0 | 2.2 | 3.5 | 5.6 | 8.0 |
沉淀完全时( )的pH )的pH | 9.0 | 3.2 | 4.7 | 6.7 | 10.0 |
(1)“滤渣a”中含硫单质,还含有
(2)已知
 的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:
的氧化性比+3价铁的强,写出“酸浸”时FeS参与反应的离子方程式:(3)除铁铝操作控制溶液的pH最小为
(4)“沉锰”中生成
 的离子方程式为
的离子方程式为(5)实验室对
 沉淀进行洗涤的操作是
沉淀进行洗涤的操作是(6)“蒸氨”所得气体为混合物,则其成分是
您最近一年使用:0次
名校
解题方法
5 . 镍催化剂的主要成分为Ni,还含有一定量Al、Fe及氧化铁、少量其他不溶性物质,回收废镍催化剂制备硫酸镍晶体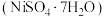 的工艺流程如下:
的工艺流程如下:
(1)提高“碱浸”速率的措施是_______ (任写两点即可)。
(2)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。该反应的化学反应方程式是_______ 。
(3)“氧化”步骤中加入 的目的是
的目的是_______ (用离子方程式表示)。
(4)“调pH”时,最适宜的pH范围是_______ 。
(5)若工艺流程改为先“调pH”后“氧化”,“滤液③”中可能含有的杂质离子为_______ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从 溶液获得稳定的
溶液获得稳定的 晶体的操作依次
晶体的操作依次_______ 。
(7)硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。该反应的离子方程式是
。该反应的离子方程式是_______ 。
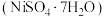 的工艺流程如下:
的工艺流程如下:
| 金属离子 |  |  |  |  |
开始沉淀时 的pH 的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的pH 的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)提高“碱浸”速率的措施是
(2)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。该反应的化学反应方程式是
(3)“氧化”步骤中加入
 的目的是
的目的是(4)“调pH”时,最适宜的pH范围是
(5)若工艺流程改为先“调pH”后“氧化”,“滤液③”中可能含有的杂质离子为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得稳定的
溶液获得稳定的 晶体的操作依次
晶体的操作依次(7)硫酸镍在强碱溶液中用
 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。该反应的离子方程式是
。该反应的离子方程式是
您最近一年使用:0次
2024-01-06更新
|
72次组卷
|
3卷引用:河北省唐山市开滦第一中学2023-2024学年高三上学期 期中考试化学试卷
名校
解题方法
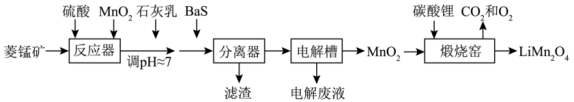
6 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量Si、Fe、Ni、Al等元素)制备
,含有少量Si、Fe、Ni、Al等元素)制备 的流程如下:
的流程如下:
已知: ,
,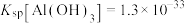 ,
, 。
。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为___________ 。为提高溶矿速率,可采取的措施___________ (举1例即可)。
(2)反应器中加入少量 的作用是
的作用是___________ 。
(3)溶矿反应完成后,反应器中溶液 ,此时c(Fe3+)≤
,此时c(Fe3+)≤___________  ;用石灰乳调节至
;用石灰乳调节至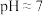 ,除去的金属离子是
,除去的金属离子是___________ 。
(4)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有___________ 。
(5)在电解槽中,发生电解反应的离子方程式为___________ 。
(6)煅烧窑中,生成 反应的化学方程式中,产物中
反应的化学方程式中,产物中 和
和 的体积比是
的体积比是___________ 。
 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量Si、Fe、Ni、Al等元素)制备
,含有少量Si、Fe、Ni、Al等元素)制备 的流程如下:
的流程如下:
已知:
 ,
,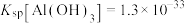 ,
, 。
。回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)反应器中加入少量
 的作用是
的作用是(3)溶矿反应完成后,反应器中溶液
 ,此时c(Fe3+)≤
,此时c(Fe3+)≤ ;用石灰乳调节至
;用石灰乳调节至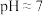 ,除去的金属离子是
,除去的金属离子是(4)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(5)在电解槽中,发生电解反应的离子方程式为
(6)煅烧窑中,生成
 反应的化学方程式中,产物中
反应的化学方程式中,产物中 和
和 的体积比是
的体积比是
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题
(1)工业制胆矾时,将粗制 粉末(含
粉末(含 、
、 杂质)慢慢加入适量的稀
杂质)慢慢加入适量的稀 中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。
中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。
已知: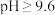 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: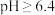 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: 接近4时,
接近4时, 以
以 的形式完全沉淀.回答下列问题:
的形式完全沉淀.回答下列问题:
①为除去 ,可先加入
,可先加入________ ,(填编号)将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为________________ ,后加入适当的________ (填编号)调节溶液的 使
使 沉淀。
沉淀。
A. B.
B. C.
C. D.
D.
②甲同学怀疑调整溶液 接近4是否能达到除去
接近4是否能达到除去 而不损失
而不损失 的目的,已知,常温下
的目的,已知,常温下 的溶度积
的溶度积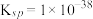 ,
, 的溶度积
的溶度积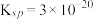 ,设溶液中
,设溶液中 的浓度为
的浓度为 ,则
,则 开始沉淀时溶液的
开始沉淀时溶液的 为
为________ , 完全沉淀时溶液的的
完全沉淀时溶液的的 为
为________ ,通过计算确定上述方案________ (填“可行”或“不可行”).
③ ,
, 溶液中由水电离出的
溶液中由水电离出的 是
是________ 。
(2)SOCl2是一种液态化合物,将其滴入水中,反应剧烈,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象,写出SOCl2和H2O反应的化学方程式:________________ 。
②利用SOCl2和AlCl3•6H2O混合共热可制备无水AlCl3,试解释原因________________ 。
(1)工业制胆矾时,将粗制
 粉末(含
粉末(含 、
、 杂质)慢慢加入适量的稀
杂质)慢慢加入适量的稀 中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。
中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:
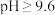 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: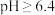 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: 接近4时,
接近4时, 以
以 的形式完全沉淀.回答下列问题:
的形式完全沉淀.回答下列问题:①为除去
 ,可先加入
,可先加入 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为 使
使 沉淀。
沉淀。A.
 B.
B. C.
C. D.
D.
②甲同学怀疑调整溶液
 接近4是否能达到除去
接近4是否能达到除去 而不损失
而不损失 的目的,已知,常温下
的目的,已知,常温下 的溶度积
的溶度积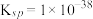 ,
, 的溶度积
的溶度积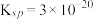 ,设溶液中
,设溶液中 的浓度为
的浓度为 ,则
,则 开始沉淀时溶液的
开始沉淀时溶液的 为
为 完全沉淀时溶液的的
完全沉淀时溶液的的 为
为③
 ,
, 溶液中由水电离出的
溶液中由水电离出的 是
是(2)SOCl2是一种液态化合物,将其滴入水中,反应剧烈,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象,写出SOCl2和H2O反应的化学方程式:
②利用SOCl2和AlCl3•6H2O混合共热可制备无水AlCl3,试解释原因
您最近一年使用:0次
名校
8 . 白云石的主要化学成分为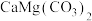 ,还含有质量分数约为2.1%的
,还含有质量分数约为2.1%的 和1.0%的
和1.0%的 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
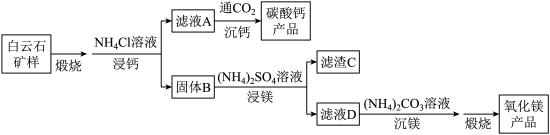
已知:
(1)白云石矿样煅烧完全分解的化学方程式为___________ 。
(2) 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。
备注:
ⅰ.MO浸出率=(浸出的MO质量/煅烧得到的MO质量)×100%(M代表Ca或Mg)
ⅱ. 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 的纯度。
的纯度。
① 溶液显酸性,原因是
溶液显酸性,原因是___________ (用化学用语解释)。
②解释“浸钙”过程中主要浸出CaO的原因是___________ 。
③下列有关滤液A及沉钙过程的说法中正确的是__________ 。
a.由于浸钙时 稍过量,所以溶液A呈酸性;
稍过量,所以溶液A呈酸性;
b.溶液A中 ;
;
c.沉钙反应的离子方程式为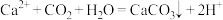 ;
;
④“浸钙”过程选用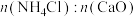 的比例为2.4:1时,碳酸钙纯度的计算值
的比例为2.4:1时,碳酸钙纯度的计算值
___________ 。
⑤产品中 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是___________ 。
(3)“浸镁”过程中,取固体B与一定浓度的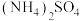 溶液混合,充分反应后MgO的浸出率低于60%。
溶液混合,充分反应后MgO的浸出率低于60%。
①浸镁反应的离子方程式是___________ 。
②加热蒸馏,MgO的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是___________ 。
(4)该流程中可循环利用的物质是___________ 。
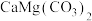 ,还含有质量分数约为2.1%的
,还含有质量分数约为2.1%的 和1.0%的
和1.0%的 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 |  |  |  |  |
 | 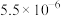 |  |  | 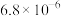 |
(2)
 用量对碳酸钙产品的影响如下表所示。
用量对碳酸钙产品的影响如下表所示。 | 氧化物(MO)浸出率/% | 产品中 纯度/% 纯度/% | 产品中Mg杂质含量/%(以 计) 计) | ||
| CaO | MgO | 计算值 | 实测值 | ||
| 2.1:1 | 98.4 | 1.1 | 99.1 | 99.7 | — |
| 2.2:1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4:1 | 99.0 | 6.0 | a | 97.6 | 2.20 |
ⅰ.MO浸出率=(浸出的MO质量/煅烧得到的MO质量)×100%(M代表Ca或Mg)
ⅱ.
 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 的纯度。
的纯度。①
 溶液显酸性,原因是
溶液显酸性,原因是②解释“浸钙”过程中主要浸出CaO的原因是
③下列有关滤液A及沉钙过程的说法中正确的是
a.由于浸钙时
 稍过量,所以溶液A呈酸性;
稍过量,所以溶液A呈酸性;b.溶液A中
 ;
;c.沉钙反应的离子方程式为
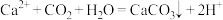 ;
;④“浸钙”过程选用
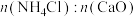 的比例为2.4:1时,碳酸钙纯度的计算值
的比例为2.4:1时,碳酸钙纯度的计算值
⑤产品中
 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是(3)“浸镁”过程中,取固体B与一定浓度的
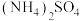 溶液混合,充分反应后MgO的浸出率低于60%。
溶液混合,充分反应后MgO的浸出率低于60%。①浸镁反应的离子方程式是
②加热蒸馏,MgO的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
(4)该流程中可循环利用的物质是
您最近一年使用:0次
2023-11-29更新
|
100次组卷
|
2卷引用:北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 某学习小组为了探究 溶液与盐溶液反应的规律,设计了如下实验:
溶液与盐溶液反应的规律,设计了如下实验:
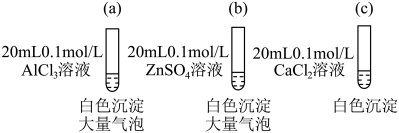
(1)分别向如下3支试管中加入2mL
 溶液,现象记录如图。
溶液,现象记录如图。
① 溶液中含碳微粒浓度由大到小的顺序:
溶液中含碳微粒浓度由大到小的顺序:___________ 。
②试管(a)中发生反应的离子反应方程式为___________ 。
(2)设计热分解实验,探究白色沉淀的成分(A、D中盛放碱石灰,C中盛放浓硫酸):

将(1)中所得三种沉淀,分别置于B中。实验结束后,数据记录如下:
①装置E中盛放的药品为___________ 。
②每份样品用酒精灯加热分解后,都要再通入一段时间空气,其目的是___________ 。
③计算可得试管(b)中沉淀的化学式为___________ 。
④试管(c)中样品最终确定为 ,试分析
,试分析 未分解的原因
未分解的原因___________ 。
(3)查表,得到几种物质的溶解度(20℃)数据如下:
①(c)中沉淀是 的原因是
的原因是___________ 。
②根据探究的结论预测,物质的量浓度均为 的
的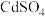 溶液和
溶液和 溶液等体积混合,得到的沉淀的化学式可能为
溶液等体积混合,得到的沉淀的化学式可能为___________ 。
 溶液与盐溶液反应的规律,设计了如下实验:
溶液与盐溶液反应的规律,设计了如下实验:(1)分别向如下3支试管中加入2mL

 溶液,现象记录如图。
溶液,现象记录如图。①
 溶液中含碳微粒浓度由大到小的顺序:
溶液中含碳微粒浓度由大到小的顺序:②试管(a)中发生反应的离子反应方程式为

(2)设计热分解实验,探究白色沉淀的成分(A、D中盛放碱石灰,C中盛放浓硫酸):

将(1)中所得三种沉淀,分别置于B中。实验结束后,数据记录如下:
| 样品 | 加热前样品质量/g | 加热后样品质量/g | C质量增重/g | D质量增重/g |
| a | 7.8 | 5.1 | 2.7 | 0 |
| b | 22.4 | 16.2 | 1.8 | 4.4 |
| c | 10.0 | 10.0 | 0 | 0 |
②每份样品用酒精灯加热分解后,都要再通入一段时间空气,其目的是
③计算可得试管(b)中沉淀的化学式为
④试管(c)中样品最终确定为
 ,试分析
,试分析 未分解的原因
未分解的原因(3)查表,得到几种物质的溶解度(20℃)数据如下:
| 物质 | 溶解度/g | 物质 | 溶解度/g | 物质 | 溶解度/g | 物质 | 溶解度/g |
 | 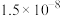 |  |  |  | 0.16 | 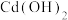 | 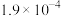 |
 | 易水解 |  | 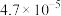 |  | 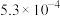 |  | 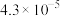 |
 的原因是
的原因是②根据探究的结论预测,物质的量浓度均为
 的
的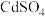 溶液和
溶液和 溶液等体积混合,得到的沉淀的化学式可能为
溶液等体积混合,得到的沉淀的化学式可能为
您最近一年使用:0次
名校
10 . 电子工业中,可用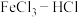 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
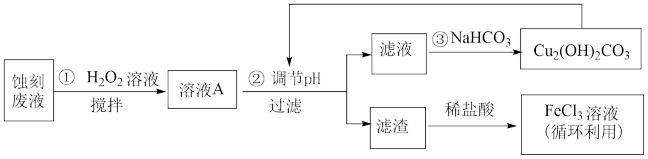
回答下列问题:
(1)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填写化学式)
(2) 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是___________ 。
(3)步骤①中加入 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)___________ 。
(4)已知:生成氢氧化物沉淀的pH如下表。
根据表中数据推测调节pH的范围是___________ 。
(5)上述流程路线中,除 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是___________ 。
(6)在25℃下,向浓度均为 的
的 溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤
溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤ )时溶液的pH为
)时溶液的pH为___________ (已知25℃时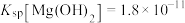 )。
)。
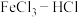 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
回答下列问题:
(1)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)
 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是(3)步骤①中加入
 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)(4)已知:生成氢氧化物沉淀的pH如下表。
 |  |  | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)上述流程路线中,除
 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是(6)在25℃下,向浓度均为
 的
的 溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤
溶液中逐滴加入氨水,此离子沉淀完全(离子浓度≤ )时溶液的pH为
)时溶液的pH为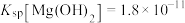 )。
)。
您最近一年使用:0次



