解题方法
1 . 某兴趣小组用下图装置研究原电池的工作原理。
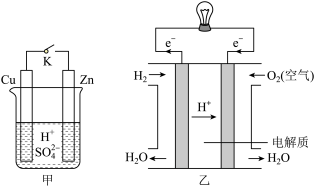
(1)甲中K断开时,装置中发生反应的离子方程式为_______________________ ;K闭合时,Cu棒上的现象为________ ,它为原电池的________ (填“正”或“负”)极。
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的________ (填“正”或“负”)极,发生________ (填“氧化”或“还原”)反应。
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:_______________________________________________ 。

(1)甲中K断开时,装置中发生反应的离子方程式为
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:
您最近一年使用:0次
解题方法
2 . 实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
(1)装置甲中铁极的电极反应式是____________ ,溶液中H+向_____ 极移动(填“正”或“负”)。
(2)装置乙中铜极发生____________ (填“氧化”或“还原”)反应。
(3)装置丙中M极为______ (填“正极”或“负极”),一段时间后溶液的酸性_____________ (填“增强”“减弱”或“不变”)。
(4)Fe、Cu、M中金属活动性最强的是_____________ 。
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 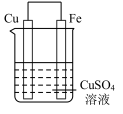 | 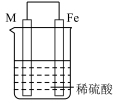 |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
(1)装置甲中铁极的电极反应式是
(2)装置乙中铜极发生
(3)装置丙中M极为
(4)Fe、Cu、M中金属活动性最强的是
您最近一年使用:0次
2020-08-08更新
|
115次组卷
|
3卷引用:山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二9月月考化学试题
名校
解题方法
3 . 如图设计的串联电池装置,R为变阻器,以调节电路电流。
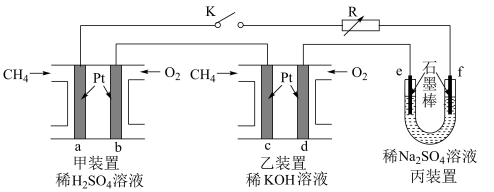
(1)写出b、c电极的电极反应式:b___ ,c___ ;
(2)写出f电极的电极反应式___ ,向此电极区域滴入酚酞的现象为:___ ;该电极区域水的电离平衡被___ (填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH___ (填“变大”、“变小”或“不变”),原因是___ 。
(4)电解一段时间后丙装置析出芒硝(Na2SO4•10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入___ gH2O就可以将析出的沉淀溶解并恢复到原有浓度。
(5)有一硝酸盐晶体,其化学式为M(NO3)x•yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为___ ;
②电解后,生成气体体积=___ (标准状况下)溶液的pH=___ (电解过程中溶液体积变化忽略不计)。要求写出计算过程。

(1)写出b、c电极的电极反应式:b
(2)写出f电极的电极反应式
(3)闭合K一段时间后,丙装置的电解质溶液pH
(4)电解一段时间后丙装置析出芒硝(Na2SO4•10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入
(5)有一硝酸盐晶体,其化学式为M(NO3)x•yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为
②电解后,生成气体体积=
您最近一年使用:0次
名校
解题方法
4 . 由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
| 装置 | 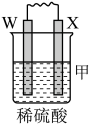 | 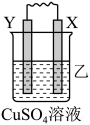 | 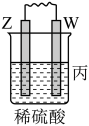 |
| 现象 | 金属W不断溶解 | Y的质量增加 | W上有气体产生 |
| A.装置甲中X作原电池正极 |
| B.装置乙中Y电极上的反应式为Cu2++2e−=Cu |
| C.装置丙中溶液的c(H+)不变 |
| D.四种金属的活动性强弱顺序为Z>W>X>Y |
您最近一年使用:0次
2020-06-16更新
|
470次组卷
|
2卷引用:江西省南昌市第二中学2019-2020学年高一下学期第二次月考化学试题
5 . 由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
| 装置 |  | 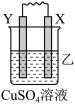 | 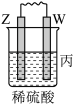 |
| 现象 | 金属W不断溶解 | Y的质量增加 | W上有气体产生 |
| A.装置甲中X作原电池正极 |
| B.装置乙中Y电极上的反应式为Cu2++2e−=Cu |
| C.装置丙中溶液的c(H+)不变 |
| D.四种金属的活动性强弱顺序为Z>W>X>Y |
您最近一年使用:0次
2020-04-30更新
|
189次组卷
|
2卷引用:江西省赣州中学2023-2024学年高二上学期月考化学试题
名校
解题方法
6 . 在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:
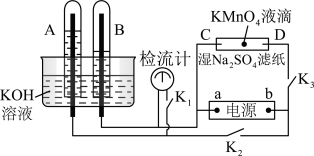
(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为_________ (填化学式)。
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为_____________ 。
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变__________ (填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为_____________

(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为
您最近一年使用:0次
2019-11-20更新
|
157次组卷
|
2卷引用:山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题
名校
解题方法
7 . 对氨基苯酚可用作农药、医药、染料等精细化学品的中间体,利用Al-PbO2电池(其装置如图甲所示)作为电源电解硝基苯制备对氨基苯酚,其装置如图乙所示。已知电池工作过程中R区的K2SO4溶液浓度增大,下列说法正确的是
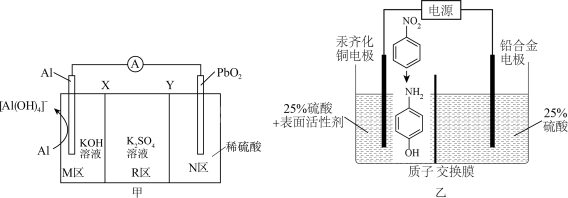
| A.X为阴离子交换膜 |
| B.铅合金电极应与Al电极相连 |
C.汞齐化铜电极上的反应式为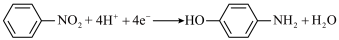 |
D.PbO2电极上的反应式为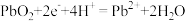 |
您最近一年使用:0次
2024-05-12更新
|
119次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性月考(九)理综试卷-高中化学
名校
8 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中作正极的是__________________ (填“A”或“B”) ;
(2)装置乙溶液中C电极反应:__________________________________ ;装置乙中反应一段时间后,测得C电极 的质量增加12.8克,则该电池反应转移电子的物质的量为___________ mol
(3)装置丙中金属A上电极反应属于______________ (填“氧化反应”或“还原反应”);
(4)四种金属活动性由强到弱的顺序是_______________________ 。
| 装置 | 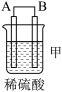 | 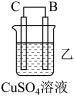 | 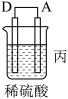 |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中作正极的是
(2)装置乙溶液中C电极反应:
(3)装置丙中金属A上电极反应属于
(4)四种金属活动性由强到弱的顺序是
您最近一年使用:0次
2019-03-28更新
|
531次组卷
|
3卷引用:【全国百强校】山东省邹平市第一中学2018-2019学年高一下学期第一次阶段性考试化学试题
名校
9 . 浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池,理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法正确的是
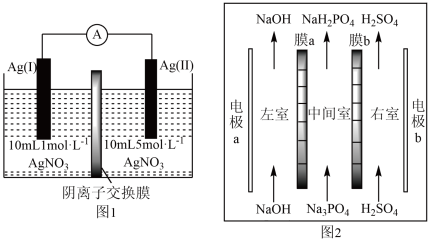
| A.电极Ag(II)的电极反应式为:Ag-e-=Ag+ |
| B.电渗析装置中膜a、b均为阳离子交换膜 |
| C.电渗析过程中左室中NaOH浓度增大,右室H2SO4的浓度减小 |
| D.电池从开始到停止放电,理论上可制备2.4gNaH2PO4 |
您最近一年使用:0次
2024-03-11更新
|
273次组卷
|
2卷引用:四川省攀枝花市第十五中学校2023-2024学年高三下学期第13次半月考理科综合试题-高中化学
名校
解题方法
10 . 乙炔制乙烯是煤化工路线的重要途径之一,如图是利用电化学装置制备 的工作原理示意图,下列说法正确的是
的工作原理示意图,下列说法正确的是
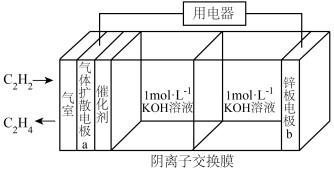
 的工作原理示意图,下列说法正确的是
的工作原理示意图,下列说法正确的是
| A.电极电势:a极<b极 |
| B.电子移动方向:电极b→用电器→电极a→KOH溶液→电极b |
C.电极a上的电极反应式为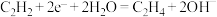 |
| D.放电一段时间后,正极室溶液pH不会发生变化 |
您最近一年使用:0次
2024-01-31更新
|
106次组卷
|
2卷引用:河南省南阳市桐柏县实验高中2024届高三上学期阶段检测化学试题(12月)



