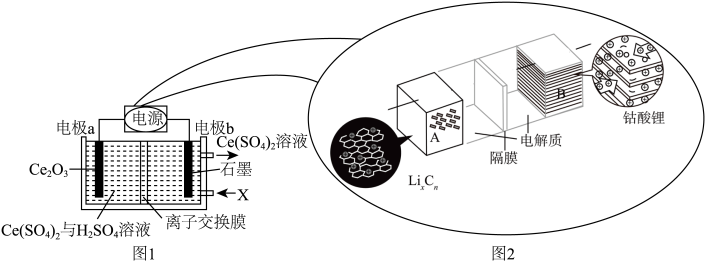
1 . 用废料Ce2O3制备Ce(SO4)2的工作原理示意图如图1所示[电源为可充电锂离子电池,该电池放电时的反应为 ]。下列说法错误的是
]。下列说法错误的是
 ]。下列说法错误的是
]。下列说法错误的是
| A.图1中的离子交换膜为阳离子交换膜 |
B.图2装置充电时,电极B的电极反应式为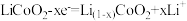 |
| C.图1装置工作一段时间后,电极a区溶液的质量减小 |
| D.锂离子电池电动汽车可有效减少光化学烟雾污染 |
您最近一年使用:0次
2023-05-18更新
|
293次组卷
|
2卷引用:湖南省部分学校2023届高三下学期5月联考化学试题
名校
2 . 用如图装置进行实验(A为电流计):
观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是

观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是
| A.图1是电解池,图2是原电池 |
| B.两个电池中,电子均由Cr电极流向Cu电极 |
| C.图2中Cr电极可能被浓HNO3钝化成惰性电极 |
| D.由实验现象可知金属活动性:Cu>Cr |
您最近一年使用:0次
2018-05-21更新
|
389次组卷
|
4卷引用:河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题
名校
解题方法
3 . 图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法错误 的是


| A.电极a应与Ag(II)相连 |
| B.电渗析装置中膜b为阳离子交换膜 |
| C.电渗析过程中左、右室中H2SO4和NaOH的浓度均增大 |
| D.电池从开始到停止放电,理论上可制备2.4gNaH2PO4 |
您最近一年使用:0次
2023-11-23更新
|
320次组卷
|
2卷引用:河南省濮阳市油田第一中学2023-2024学年高三上学期培优测试理科综合化学试题
名校
解题方法
4 . 2021年6月24日,《一种硫酸铜废液制备高纯氧化铜》获得第22届中国专利优秀奖,其工艺流程如图:
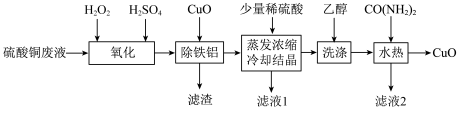
已知:①硫酸铜废液中的杂质离子仅含Na+、Fe2+、Fe3+、Al3+等。
②25℃时的溶度积:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.25×10-33。
回答下列问题:
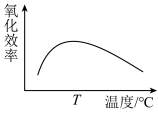
(1)双氧水能把Fe2+氧化为Fe3+,写出反应的离子方程式________ ;如图是双氧水的氧化效率随温度变化的曲线,请解释氧化效率变化的原因________ 。
(2)“除铁铝”时,为使Fe3+和Al3+沉淀完全(溶液中剩余离子的浓度小于1×10-5mol•L-1),需加入CuO调节溶液pH至______ (lg2=0.3)。
(3)“洗涤”目的是为了除去硫酸铜晶体表面沾附的少量杂质,杂质的化学式为______ ,洗涤所需要的玻璃仪器有______ ,判断晶体洗涤干净的实验操作是________ 。
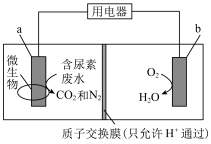
(4)如图装置可在净化含尿素[CO(NH2)2]废水的同时提供电能,以下说法正确的是________ 。

已知:①硫酸铜废液中的杂质离子仅含Na+、Fe2+、Fe3+、Al3+等。
②25℃时的溶度积:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.25×10-33。
回答下列问题:
(1)双氧水能把Fe2+氧化为Fe3+,写出反应的离子方程式

(2)“除铁铝”时,为使Fe3+和Al3+沉淀完全(溶液中剩余离子的浓度小于1×10-5mol•L-1),需加入CuO调节溶液pH至
(3)“洗涤”目的是为了除去硫酸铜晶体表面沾附的少量杂质,杂质的化学式为
(4)如图装置可在净化含尿素[CO(NH2)2]废水的同时提供电能,以下说法正确的是

| A.温度越高,反应速率越快,装置的转化率越高 |
| B.该装置工作时,b为正极,发生还原反应 |
C.装置内溶液电流的方向由 到 到 ,电子的流向与之相反 ,电子的流向与之相反 |
| D.工作一段时间后,正极区域pH会显著升高 |
您最近一年使用:0次
5 . 工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
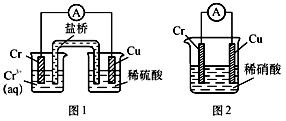

| A.图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中 |
| B.由实验现象可知:金属活动性Cu>Cr |
| C.图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+ |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
您最近一年使用:0次
2018-04-10更新
|
241次组卷
|
2卷引用:重庆市第一中学2017-2018学年高二下学期第一次月考化学试题
名校
6 . 盐酸羟胺 主要用作还原剂和定影剂。以外排烟气中的
主要用作还原剂和定影剂。以外排烟气中的 以及
以及 、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
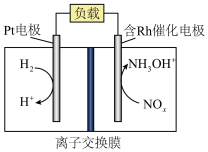
 主要用作还原剂和定影剂。以外排烟气中的
主要用作还原剂和定影剂。以外排烟气中的 以及
以及 、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
A.制备总反应方程式为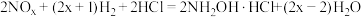 |
| B.该电化学装置中的离子交换膜最好选择质子交换膜 |
| C.制备过程中,Pt电极所在极室溶液的pH基本保持不变 |
D.每生成1mol盐酸羟胺,电路中转移电子的物质的量: |
您最近一年使用:0次
名校
解题方法
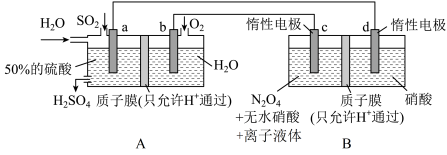
7 . 硝化剂可在化学反应中向有机化合物中引入硝基、硝酸酯基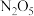 是一种绿色硝化剂。有人设想利用工业废气
是一种绿色硝化剂。有人设想利用工业废气 ,依据电化学原理制备
,依据电化学原理制备 和
和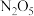 。装置图如下,下列说法
。装置图如下,下列说法不正确 的是
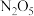 是一种绿色硝化剂。有人设想利用工业废气
是一种绿色硝化剂。有人设想利用工业废气 ,依据电化学原理制备
,依据电化学原理制备 和
和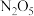 。装置图如下,下列说法
。装置图如下,下列说法
A.装置 可将电能转化为化学能 可将电能转化为化学能 |
B.装置 中H从a极区迁移到b极区 中H从a极区迁移到b极区 |
C.c电极表面生成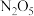 ,电极反应式为: ,电极反应式为: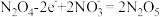 |
D.反应过程中 装置d区 装置d区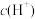 保持不变 保持不变 |
您最近一年使用:0次
2023-10-13更新
|
410次组卷
|
2卷引用:湖北省重点高中智学联盟2023-2024学年高三上学期10月联考化学试题
解题方法
8 . 一种新型镁储备电池储存寿命长,电压平稳,电池反应为Mg+Cu2Cl2=2Cu+MgCl2。实验室以该电池为电源处理含Na2SO4废水,同时制备NaOH和H2SO4的装置如图所示。下列说法错误的是


| A.M电极材料为Mg |
| B.ab为阴离子交换膜 |
| C.N极的电极反应式为Cu2Cl2+2e-=2Cu+2Cl- |
| D.电路上每通过4mole-,阴阳两极总共产生67.2L气体 |
您最近一年使用:0次
名校
解题方法
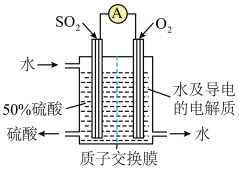
9 . 化学性质类似NH4Cl的盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂。工业上主要采用图1所示的方法制备,其电池装置中含Fe的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有Cl-、 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
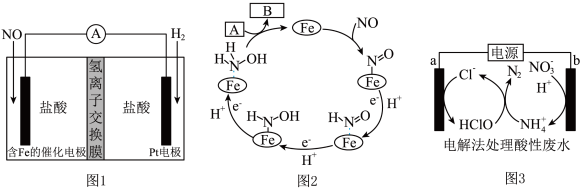
 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
| A.图1为原电池,含Fe的催化电极为负极 |
| B.图1电池工作时,每消耗3.36LH2(标准状况下),左室溶液质量增加3.3g |
| C.图2中A为H+和e-,B为NH3OH+ |
D.图3中处理 ,酸性废水中Cl-减少5mol ,酸性废水中Cl-减少5mol |
您最近一年使用:0次
2023-10-11更新
|
307次组卷
|
4卷引用:山东省青岛第二中学2023-2024学年高二上学期10月月考化学试题
解题方法
10 . I.某科研单位利用电化学原理,使用 来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许
来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许 通过。
通过。
(1)通入 的电极为
的电极为_______ (填“正极”或“负极”),其电极反应式为_______ ,此电极区溶液的pH________ (填“增大”“减小”或“不变”)。
(2)电解质溶液中的 通过质子交换膜
通过质子交换膜_______ (填“向左”或“向右”)移动,通入 的电极反应式为
的电极反应式为_______ 。
Ⅱ.如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,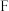 极附近呈红色。
极附近呈红色。

(3)B极是电源的_______ (填“正极”或“负极”),一段时间后,丁中 极附近的颜色逐渐
极附近的颜色逐渐_______ (填“变深”或“变浅”)。
(4)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_______ 。
 来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许
来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许 通过。
通过。
(1)通入
 的电极为
的电极为(2)电解质溶液中的
 通过质子交换膜
通过质子交换膜 的电极反应式为
的电极反应式为Ⅱ.如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,
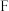 极附近呈红色。
极附近呈红色。
(3)B极是电源的
 极附近的颜色逐渐
极附近的颜色逐渐(4)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为
您最近一年使用:0次



