名校
解题方法
1 . I.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________ 。
(2)装置乙中正极的电极反应式是________________________________________ 。
(3)四种金属活泼性由强到弱的顺序是______________________ 。
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。
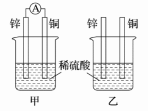
(1)下列叙述正确的是________ 。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是________________________________________________________________________ 。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应________________________ 。
| 装置 |  | 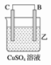 | 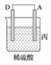 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)四种金属活泼性由强到弱的顺序是
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。

(1)下列叙述正确的是
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应
您最近一年使用:0次
2018-07-17更新
|
615次组卷
|
4卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高一下学期期末考试化学试题
2 . 锌铜——稀硫酸原电池的装置如图所示,下列叙述错误的是
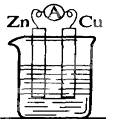

| A.电流从锌片经导线流向铜片 | B.锌是负极,其质量逐渐减小 |
| C.氢离子在铜表面被还原,产生气泡 | D.依据该实验现象可判断锌比铜活泼 |
您最近一年使用:0次
2018-07-04更新
|
114次组卷
|
2卷引用:【全国市级联考】湖北省襄阳市2017-2018学年高一下学期期末调研统一考试化学试题
名校
3 . 盐酸羟胺(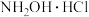 )是一种常见的还原剂,工业上采用如图1所示方法利用NO制备盐酸羟胺,图2是用图1的电池处理含Cl-,
)是一种常见的还原剂,工业上采用如图1所示方法利用NO制备盐酸羟胺,图2是用图1的电池处理含Cl-, 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
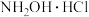 )是一种常见的还原剂,工业上采用如图1所示方法利用NO制备盐酸羟胺,图2是用图1的电池处理含Cl-,
)是一种常见的还原剂,工业上采用如图1所示方法利用NO制备盐酸羟胺,图2是用图1的电池处理含Cl-, 的酸性废水的装置。下列说法正确的是
的酸性废水的装置。下列说法正确的是
| A.图2电解池工作时a电极应与Pt电极相连 |
B.处理1mol ,电路中转移5mole- ,电路中转移5mole- |
| C.电池工作时,每消耗2.24 L(标准状况下)NO,左室溶液质量增加3.3g |
| D.电池工作一段时间后,正负极区溶液的pH均下降 |
您最近一年使用:0次
2024-02-01更新
|
336次组卷
|
2卷引用:山西省忻州市2023-2024学年高三上学期1月期末理综试题-高中化学
名校
4 . 为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确 的是
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,
| A.实验①、②说明锌能与稀硫酸反应产生氢气,而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明该装置可形成原电池 |
您最近一年使用:0次
名校
解题方法
5 . 某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
①通过实验2和3,可得出原电池的形成条件是______________________________ 。
②通过实验1和3,可得出原电池的形成条件是______________________________ 。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________ 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________ 。
Cu棒:______________________________ 。
(3)实验3的电流是从________ 棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________ g。
(1)请填写有关实验现象并得出相关结论。
| 编号 | 实验装置 | 实验现象 |
| 1 | 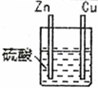 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
| 2 | 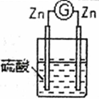 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
| 3 | 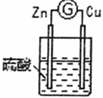 | 铜棒表面的现象是 |
①通过实验2和3,可得出原电池的形成条件是
②通过实验1和3,可得出原电池的形成条件是
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:
Cu棒:
(3)实验3的电流是从
您最近一年使用:0次
2018-07-16更新
|
645次组卷
|
6卷引用:【全国市级联考】河北省唐山市2017-2018学年高一下学期期末考试(A)化学试题
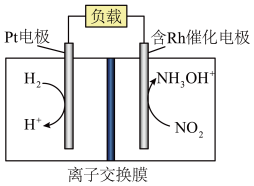
6 . 盐酸羟胺 主要用作还原剂和定影剂,是一种易溶于水的盐。以
主要用作还原剂和定影剂,是一种易溶于水的盐。以 、
、 、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
 主要用作还原剂和定影剂,是一种易溶于水的盐。以
主要用作还原剂和定影剂,是一种易溶于水的盐。以 、
、 、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
、盐酸为原料通过电化学方法一步制备盐酸羟胺的装置示意图如下。下列说法错误的是
A.盐酸羟胺在水溶液中的电离方程式为: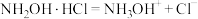 |
B.正极的电极反应为: |
| C.该电化学装置中的离子交换膜最好选择质子交换膜 |
D.电池工作时,每消耗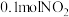 ,右室溶液质量增加 ,右室溶液质量增加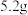 |
您最近一年使用:0次
2023-04-23更新
|
283次组卷
|
2卷引用:江西省宜春市上高中学2022-2023学年高一下学期7月期末考试化学试题
解题方法
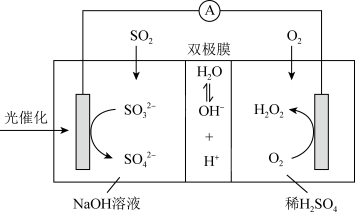
7 . 我国科研人员设计将脱除 的反应与制备
的反应与制备 相结合的协同转化装置如图。在电场作用下,双极膜中间层的
相结合的协同转化装置如图。在电场作用下,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移。已知:①单独制备
,并向两极迁移。已知:①单独制备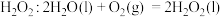 ,不能自发进行;②单独脱除
,不能自发进行;②单独脱除 :
: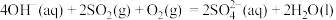 能自发进行。下列说法
能自发进行。下列说法不正确 的是
 的反应与制备
的反应与制备 相结合的协同转化装置如图。在电场作用下,双极膜中间层的
相结合的协同转化装置如图。在电场作用下,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移。已知:①单独制备
,并向两极迁移。已知:①单独制备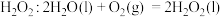 ,不能自发进行;②单独脱除
,不能自发进行;②单独脱除 :
: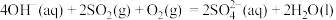 能自发进行。下列说法
能自发进行。下列说法
A.②单独脱除 反应的 反应的 |
B.协同转化工作时, 透过双极膜向左侧移动 透过双极膜向左侧移动 |
C.正极的电极反应式: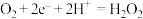 |
D.协同转化总反应: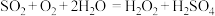 |
您最近一年使用:0次
名校
解题方法
8 . 全钒液流电池是化学储能领域的一个研究热点,储能容量大、使用寿命长,利用该电池电解处理含 的废水制备硝酸和氨水的原理如图所示,
的废水制备硝酸和氨水的原理如图所示, 电极均为惰性电极。
电极均为惰性电极。
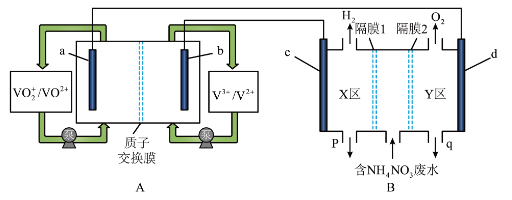
回答下列问题:
(1) 电极为
电极为___________ (填“正极”或“负极”), 电极反应式为
电极反应式为___________ 。
(2)隔膜1为___________ 交换膜(填“阴离子”或“阳离子”),q口流出液含有的溶质为___________ (填化学式),d电极的电极反应式为___________ 。
(3)B装置中产生的气体总量为 (标准状况下)时,通过质子交换膜的
(标准状况下)时,通过质子交换膜的  的物质的量为
的物质的量为___________  。
。
 的废水制备硝酸和氨水的原理如图所示,
的废水制备硝酸和氨水的原理如图所示, 电极均为惰性电极。
电极均为惰性电极。
回答下列问题:
(1)
 电极为
电极为 电极反应式为
电极反应式为(2)隔膜1为
(3)B装置中产生的气体总量为
 (标准状况下)时,通过质子交换膜的
(标准状况下)时,通过质子交换膜的  的物质的量为
的物质的量为 。
。
您最近一年使用:0次
名校
9 . 按要求回答问题:
(1)由SiO2制备高纯度硅的工业流程如图所示:
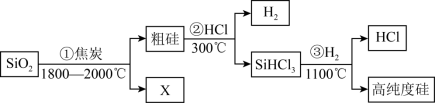
①写出SiO2转化为Si(粗)的化学方程式:____________________________________________ 。
②可以循环使用的物质为_________________________ 。
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
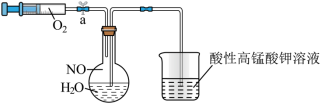
①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是____________ ,产生此现象的化学方程式为______________________________________________ 。
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式________________________________ 。
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向________ 极移动(填“正”或“负”)。
②若有 1 mol e- 流过导线,则理论上负极质量减少________ g。
③若将稀硫酸换成浓硝酸,正极电极方程式为:______________________ 。
(1)由SiO2制备高纯度硅的工业流程如图所示:

①写出SiO2转化为Si(粗)的化学方程式:
②可以循环使用的物质为
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向
②若有 1 mol e- 流过导线,则理论上负极质量减少
③若将稀硫酸换成浓硝酸,正极电极方程式为:
您最近一年使用:0次
2023-05-18更新
|
326次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题
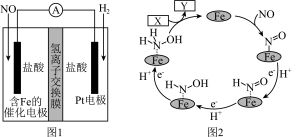
10 . 盐酸羟胺(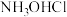 )是一种常见的还原剂和显像剂,其化学性质类似
)是一种常见的还原剂和显像剂,其化学性质类似 。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是
。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是
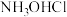 )是一种常见的还原剂和显像剂,其化学性质类似
)是一种常见的还原剂和显像剂,其化学性质类似 。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是
。工业上采用图1装置进行制备,其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积的变化,下列说法正确的是
| A.电子从含Fe的催化电极流出沿导线流入Pt电极 |
B.图2中,X为 和 和 ,Y为 ,Y为 |
| C.电池工作一段时间后,正极区溶液的pH减小 |
D.理论上,当有标准状况下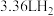 参与反应时,左室溶液质量增加3.3g 参与反应时,左室溶液质量增加3.3g |
您最近一年使用:0次



