解题方法
1 . 理论上放热的氧化还原反应都可以设计成原电池,关于该反应Fe+2H+=Fe2++H2↑设计成原电池的说法中正确的是
| A.硝酸可能为电解质溶液 | B.工作时溶液H+向负极移动 |
| C.负极反应为2H++2e-=H2 | D.碳棒可能为原电池正极 |
您最近一年使用:0次
2 . 回答下列问题
I.某温度下,在2L容器中三种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。
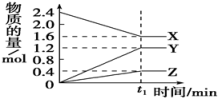
(1)该反应的化学方程式是___________
(2)在t1min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___________。
(3)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为___________ ;用N2表示这段时间内该反应的平均速率v=___________ 。(用含t1的式子表示)
II.如图所示,组成一个原电池。
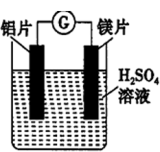
(4)当电解质溶液为稀硫酸时,镁片的电极是___________ 极(填“正”或“负”),其中铝片上电极反应式___________ ,外电路中的电子是___________ 极流向___________ 极。(填“铝片”或“镁片”)
(5)当电解质溶液为氢氧化钠溶液时,镁片电极是___________ 极(填“正”或“负”),该反应是___________ (填“氧化”或“还原”)反应。
I.某温度下,在2L容器中三种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。

(1)该反应的化学方程式是
(2)在t1min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___________。
| A.X、Y、Z的反应速率相等 |
| B.X、Y的反应速率比为2∶3 |
| C.Z的物质的量不在变化 |
| D.生成3molY的同时生成1molZ |
II.如图所示,组成一个原电池。

(4)当电解质溶液为稀硫酸时,镁片的电极是
(5)当电解质溶液为氢氧化钠溶液时,镁片电极是
您最近一年使用:0次
2021-08-31更新
|
238次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2020-2021学年高一下期期末测试理科化学试题
解题方法
3 . 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是
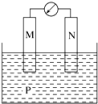

| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 浓硝酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 铝 | 铁 | 硝酸铁溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 分别按图甲乙所示装置进行实验,两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表。
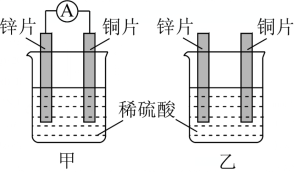
(1)下列叙述正确的是___________
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片作正极,乙中铜片作负极
C. 两烧杯溶液中 浓度均减小
浓度均减小
D. 甲产生气泡的速率比乙慢
(2)在甲装置中,若把稀硫酸换成CuSO4溶液,一段时间后测得某一电极增重12.8g,则该电池反应共转移电子数目___________
(3)甲装置中的能量转化形式为___________ 能转化为___________ 能,乙装置中的能量转化形式为___________ 能转化为___________ 能
(4)如果将反应2FeCl3+Fe=3FeCl2设计成原电池,则正极电极反应为___________ ,正极材料是___________ ,负极材料是___________ ,电解质溶液是___________ 。

(1)下列叙述正确的是
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片作正极,乙中铜片作负极
C. 两烧杯溶液中
 浓度均减小
浓度均减小D. 甲产生气泡的速率比乙慢
(2)在甲装置中,若把稀硫酸换成CuSO4溶液,一段时间后测得某一电极增重12.8g,则该电池反应共转移电子数目
(3)甲装置中的能量转化形式为
(4)如果将反应2FeCl3+Fe=3FeCl2设计成原电池,则正极电极反应为
您最近一年使用:0次
名校
解题方法
5 . 利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,如图。下列说法错误的是
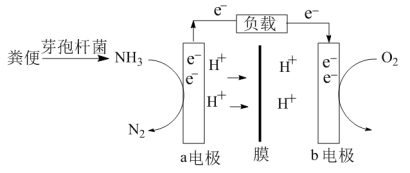

| A.a电极是负极,b电极是正极 |
| B.负极区发生的反应是2NH3 - 6e-=N2+6H+ |
| C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子 |
| D.负极区,每消耗标准状况下2.24 LNH3,a向b电极转移0.6 mol电子 |
您最近一年使用:0次
2021-08-26更新
|
327次组卷
|
2卷引用:浙江省余姚市第七中学2020-2021学年高一下学期第一次阶段性考试化学试题
6 . 如图为一原电池装置,下列说法错误的是
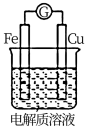

| A.若电解质溶液为稀硫酸,Fe电极上发生反应:Fe-2e-=Fe2+ |
| B.若电解质溶液为浓硝酸,则Cu为负极 |
| C.若电解质溶液为NaCl溶液,Cu电极上有气体产生 |
| D.若电解质溶液更换为酒精,电流表指针不偏转 |
您最近一年使用:0次
名校
解题方法
7 . 汽车的启动电源常用铅酸蓄电池,该电池在放电时的总反应方程式为:PbO2(s)+Pb(s)+ 2H2SO4(aq)=2PbSO4(s)+2H2O(l),根据此反应判断下列叙述正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为Pb −2e- =Pb2+ |
| C.铅酸蓄电池放电时,每转移2 mol电子消耗1 mol H2SO4 |
| D.电池放电时,两电极质量均增加,且每转移1 mol电子正极质量增加32g |
您最近一年使用:0次
2021-08-26更新
|
235次组卷
|
2卷引用:黑龙江省齐齐哈尔市2020-2021学年高一下学期期末考试化学试题
解题方法
8 . 探究原电池原理并应用原电池原理制作多种电池,对现实生活具有重要的意义。
(1)某化学兴趣小组为了探究铝电极在原电池中的作用时,设计了如下实验:
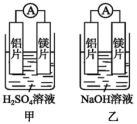
①甲、乙两装置工作时,电流计指针的偏转方向是否相同?_______ 。乙装置中负极的电极反应式是_______ 。
②根据上述实验结果分析,下列说法正确的是__________
a.构成原电池负极的金属总是比正极活泼
b.镁的金属活泼性不一定比铝的强
c.金属在原电池中作正极还是负极,既与金属活泼性有关,还与电解质溶液的成分有关
(2)铅酸蓄电池是常见的二次电池,放电时发生反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。该电池的负极材料为_______ ;该电池充电时,其能量转化形式为_______ 。
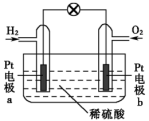
(3)氢氧燃料电池具有清洁、安全、高效的特点,其简易装置如图所示:铂电极b上的电极反应式为_______ ,室温下,若该电池消耗1molH2时可提供电能257.4kJ的能量,则该燃料电池的能量转化率为_______ 。(已知:室温下,1molH2完全燃烧生成液态水时,释放286.0kJ的能量。)
(1)某化学兴趣小组为了探究铝电极在原电池中的作用时,设计了如下实验:

①甲、乙两装置工作时,电流计指针的偏转方向是否相同?
②根据上述实验结果分析,下列说法正确的是
a.构成原电池负极的金属总是比正极活泼
b.镁的金属活泼性不一定比铝的强
c.金属在原电池中作正极还是负极,既与金属活泼性有关,还与电解质溶液的成分有关
(2)铅酸蓄电池是常见的二次电池,放电时发生反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。该电池的负极材料为
(3)氢氧燃料电池具有清洁、安全、高效的特点,其简易装置如图所示:铂电极b上的电极反应式为

您最近一年使用:0次
名校
解题方法
9 . 质量相同的铁棒、碳棒和足量CuCl2溶液组成的装置如图所示,下列说法正确的是
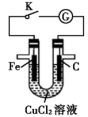

| A.闭合K,电子通过CuCl2溶液移到碳棒上 |
| B.闭合K,铁棒表面发生的电极反应为Cu2++2e-=Cu |
| C.闭合K,转移电子0.2mol时,理论上碳棒与铁棒的质量差为12g |
| D.打开K,与闭合K时发生的总反应相同 |
您最近一年使用:0次
2021-08-23更新
|
399次组卷
|
3卷引用:山东省聊城市2020-2021学年高一下学期期末考试化学试题
10 . 物质发生化学反应时,常常伴随有能量变化。某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
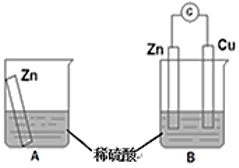
(1)A烧杯中反应的离子方程式为___________ 。
(2)B中Zn板是___________ 极,发生反应的电极反应式是___________ 。
(3)从能量转化的角度来看,A、B中反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为___________ ,B中是将化学能转变为___________ 。
(4)该小组同学反思原电池的原理,其中观点正确的是___________(填字母序号)。

(1)A烧杯中反应的离子方程式为
(2)B中Zn板是
(3)从能量转化的角度来看,A、B中反应物的总能量
(4)该小组同学反思原电池的原理,其中观点正确的是___________(填字母序号)。
| A.原电池反应的过程中一定有电子转移 |
| B.原电池装置需要2个电极 |
| C.电极一定都参加反应 |
| D.氧化反应和还原反应可以拆开在两极发生 |
您最近一年使用:0次



