1 . γ-丁内酯为无色油状液体,高温时易分解,是重要的化工原料和医药中间体。工业利用1,4-丁二醇生产γ-丁内酯的主、副反应的化学方程式如下:
主反应: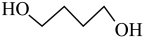 (g)
(g)
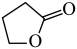 (g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1
(g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1
副反应: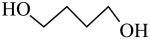 (g)
(g)
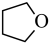
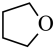 (g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1
(g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1
(1)反应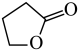 (g)+2H2(g)
(g)+2H2(g)
 (g)+H2O(g)的△H=
(g)+H2O(g)的△H=_______ kJ•mol-1。
(2)由1,4-丁二醇合成γ-丁内酯的一种机理如图所示(“★”表示此微粒吸附在催化剂表面)
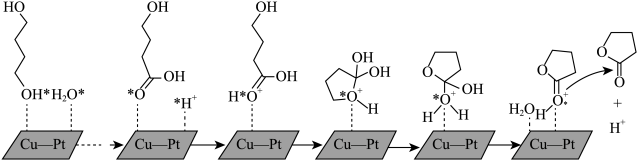
①步骤Ⅱ历程是质子化的过程,H+和氧原子间形成的作用力是______ 。
②H+在上述合成γ-丁内酯过程中的作用是_______ 。
③γ-丁内酯分子中σ键与π键数目之比为_______ 。
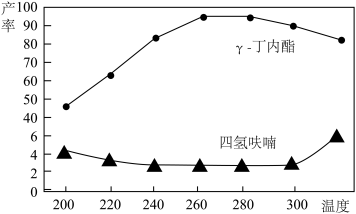
(3)将1,4-丁二醇与H2的混合气体以一定流速通过填充有催化剂的反应器,反应相同时间,测得γ-丁内酯和四氢呋喃的产率如图所示。
已知:1,4-丁二醇的沸点为228℃。
①当温度低于220℃,1,4-丁二醇的转化率较低,可能的原因是_______ 。
②当温度高于260℃,γ-丁内酯的产率下降,可能的原因是_______ 。
(4)铜基催化剂(Cu/Pt)能高效加快由1.4-丁二醇合成γ-丁内酯的合成速率,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①1,4-丁二醇中混有少量的1,4-丁二硫醇(HSCH2CH2CH2CH2SH)。合成时加入ZnO可有效避免铜基催化剂失活,其原理用化学反应方程式表示为_______ 。
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原,结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是______ 。
(5)含有1,4-丁二醇的强酸性污水可用“铁碳微电池”法处理,过程中两电极分别产生的Fe2+和活性氢原子(H•)都具有较高的化学活性,在厌氧条件下将1,4-丁二醇转化为甲烷,假设两电极只生成Fe2+和H•,且全部参与该转化过程,写出该过程的离子方程式:_______ 。
主反应:
 (g)
(g)
 (g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1
(g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1副反应:
 (g)
(g)
 (g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1
(g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1(1)反应
 (g)+2H2(g)
(g)+2H2(g)
 (g)+H2O(g)的△H=
(g)+H2O(g)的△H=(2)由1,4-丁二醇合成γ-丁内酯的一种机理如图所示(“★”表示此微粒吸附在催化剂表面)

①步骤Ⅱ历程是质子化的过程,H+和氧原子间形成的作用力是
②H+在上述合成γ-丁内酯过程中的作用是
③γ-丁内酯分子中σ键与π键数目之比为
(3)将1,4-丁二醇与H2的混合气体以一定流速通过填充有催化剂的反应器,反应相同时间,测得γ-丁内酯和四氢呋喃的产率如图所示。
已知:1,4-丁二醇的沸点为228℃。
①当温度低于220℃,1,4-丁二醇的转化率较低,可能的原因是
②当温度高于260℃,γ-丁内酯的产率下降,可能的原因是

(4)铜基催化剂(Cu/Pt)能高效加快由1.4-丁二醇合成γ-丁内酯的合成速率,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①1,4-丁二醇中混有少量的1,4-丁二硫醇(HSCH2CH2CH2CH2SH)。合成时加入ZnO可有效避免铜基催化剂失活,其原理用化学反应方程式表示为
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原,结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是
(5)含有1,4-丁二醇的强酸性污水可用“铁碳微电池”法处理,过程中两电极分别产生的Fe2+和活性氢原子(H•)都具有较高的化学活性,在厌氧条件下将1,4-丁二醇转化为甲烷,假设两电极只生成Fe2+和H•,且全部参与该转化过程,写出该过程的离子方程式:
您最近一年使用:0次
解题方法
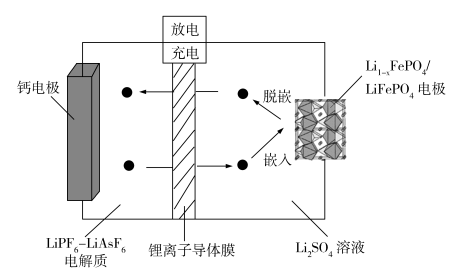
2 . 一款新型的Ca-LiFePO4可充电电池的工作示意图如图,锂离子导体膜只允许Li+通过。该电池总反应式为:xCa2++2LiFePO4 xCa+2Li1-xFePO4+2xLi+。下列说法
xCa+2Li1-xFePO4+2xLi+。下列说法不正确 的是
 xCa+2Li1-xFePO4+2xLi+。下列说法
xCa+2Li1-xFePO4+2xLi+。下列说法
| A.充电时,钙电极与直流电源的负极相连 |
| B.充电时,每转移0.2mol电子左室中电解质的质量减轻4.0g |
| C.Li1-xFePO4/LiFePO4电极充电时发生Li+脱嵌,放电时发生Li+嵌入 |
| D.放电时,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4 |
您最近一年使用:0次
解题方法
3 . 锂锰电池的体积小,性能优良,是常用的一次电池。该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移进入MnO2晶格中,生成LiMnO2。回答下列问题:

(1)外电路的电流方向是由_______ (填“a”或“b”,下同)极流向_______ 极。电源的负极为_______ 。发生的反应类型为_______ (填氧化反应或还原反应)
(2)电池的正极反应式为_______ 。

(1)外电路的电流方向是由
(2)电池的正极反应式为
您最近一年使用:0次
名校
4 . 羟胺(NH2OH)常用于有机合成。一种电化学法制取盐酸羟胺(NH3OHCl)的装置原理如下图所示,已知铁可作NO反应的催化剂。下列说法正确的是


| A.放电时Pt电极有Cl2生成 |
| B.放电时的正极反应式为NO+3e-+4H+=NH3OH+ |
| C.放电时,电路中每转移1mol eˉ,负极区将增加1mol H+ |
| D.将质子交换膜改成阴离子交换膜,放电时的电极反应将发生变化 |
您最近一年使用:0次
2022-05-26更新
|
696次组卷
|
3卷引用:江苏省淮阴中学2023届高三下学期最后一模化学试题
名校
解题方法
5 . 科学家利用氨硼烷设计成原电池装置如下图所示,该电池在常温下即可工作,总反应为NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是
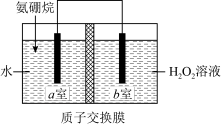

| A.该装置将电能转化为化学能 |
| B.b室为该原电池的负极区 |
C.a室发生的电极反应式为NH3·BH3+2H2O-6e-=NH +BO +BO +6H+ +6H+ |
| D.放电过程中,H+通过质子交换膜由b室移向a室 |
您最近一年使用:0次
2021-07-22更新
|
347次组卷
|
5卷引用:江苏省淮安市2020-2021学年高二下学期期末调研测试化学试题
江苏省淮安市2020-2021学年高二下学期期末调研测试化学试题(已下线)1.2.1 原电池的工作原理-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)4.1.2 化学电源(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省盐城市伍佑中学2021-2022学年高二下学期第一次阶段考试化学试题第四章 第一节 原电池 第2课时 化学电源
解题方法
6 . 锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O=2LiOH+H2↑。电池工作时,下列说法正确的是
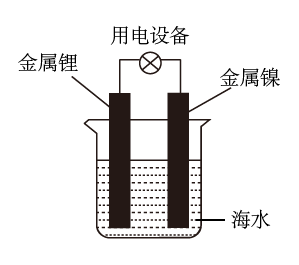

| A.该装置将电能转化为化学能 |
| B.电子从锂电极经导线流向镍电极 |
| C.金属锂作负极,发生还原反应 |
| D.理论上每转移2 mol电子可以生成22.4 LH2 |
您最近一年使用:0次
名校
解题方法
7 . 下列有关离子方程式正确的是
A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO +4NH +4NH +2H2O +2H2O |
B.NH4HCO3溶液与足量的NaOH溶液混合加热:NH +OH- +OH- NH3↑+H2O NH3↑+H2O |
| C.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ |
| D.把反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,其正极反应为:Fe3++e-=Fe2+ |
您最近一年使用:0次
2021-05-03更新
|
168次组卷
|
3卷引用:江苏省淮安市金湖、洪泽等六校2020-2021学年高一下学期联考期中考试(第六次学情调查)化学试题
解题方法
8 . 能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为________ 能,水分解时断裂的化学键是________ (填“离子键”或“共价键”)
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是____________
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3
C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)下列化学反应在理论上可以设计成原电池的是________ 。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.C+H2O CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
(4)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。

①电极a为原电池的________ (填“正极”或“负极”),该极的电极反应式为______________________ ;电极b上发生________ 反应(填“氧化”或“还原”)。
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为________ 。
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3
C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)下列化学反应在理论上可以设计成原电池的是
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.C+H2O
 CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO+H2 D.Ba(OH)2+H2SO4=BaSO4+2H2O(4)美国NASA曾开发一种铁·空气电池,其原理如图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。

①电极a为原电池的
②原电池工作一段时间后,若消耗铁22.4g,则电路中通过的电子数为
您最近一年使用:0次
2020-05-18更新
|
264次组卷
|
3卷引用:江苏省淮安市金湖、洪泽等六校2020-2021学年高一下学期联考期中考试(第六次学情调查)化学试题
解题方法
9 . 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是


| A.放电过程中,Cl-向正极移动 |
| B.正极反应式:PbSO4+2e-=Pb+SO42- |
| C.反应每转移0.1mol电子,负极理论上消耗4g Ca |
| D.常温时,在正负极间接上电流表,指针发生偏转 |
您最近一年使用:0次
10 . 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是


| A.铁被氧化的电极反应式为Fe−3e−=Fe3+ |
| B.铁腐蚀过程中化学能全部转化为电能 |
| C.活性炭的存在会加速铁的腐蚀 |
| D.以水代替NaCl溶液,铁不能发生吸氧腐蚀 |
您最近一年使用:0次
2019-06-10更新
|
10548次组卷
|
76卷引用:江苏省淮安市涟水县第一中学2021届高三上学期10月月考化学试题
江苏省淮安市涟水县第一中学2021届高三上学期10月月考化学试题2019年江苏省高考化学试题(已下线)专题08 电化学及其应用——2019年高考真题和模拟题化学分项汇编河南省南阳市第一中学2018-2019学年高一下学期第六次月考化学试题山东省淄博市第七中学2019-2020学年高三上学期第一次月考化学试题浙江省温州十五校联合体2019-2020学年高二上学期期中联考化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题上海交通大学附中2019-2020学年高三上学期期中考试化学试题(已下线)2019年12月10日 《每日一题》化学人教版(选修4)——钢铁的电化学腐蚀贵州省遵义市南白中学2019-2020学年高二上学期第三次月考化学试题2020届人教版高三化学二轮复习选择题专攻练——电化学2020届高三化学知识点强化训练----化学能与电能专题2.4 电化学(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山西省临汾市2020届高三上学期第二次月考化学试题江苏省常州市田家炳高级中学 2019-2020学年高二上学期12月份阶段调研考试化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省牡丹江市第一高级中学2020届高三下学期4月线上线下教学检测理综化学试题江苏省南京市南京师I范大学附属中学 2019-2020 学年高二下学期期中考试化学试题上海市长宁区2020届高三第二次模拟化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测河北省鸡泽县第一中学2019-2020学年高一下学期开学考试化学试题黑龙江省七台河市第一中学2019-2020学年高一下学期期末考试化学试题广东省云浮市2019-2020学年高二上学期期末考试化学试题四川省成都艺术高级中学2020-2021学年高三上学期开学考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护1浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关福建省福州市八县(市)一中2020-2021学年高二上学期期中联考化学试题福建省福州市八县(市)协作校2020-2021学年高二上学期期中考试化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(已下线)高中化学苏教2019版必修第二册-专题6 第三单元综合拔高练江苏省泰州中学2020-2021学年高二上学期第一次月度质量检测化学试题(已下线)【浙江新东方】绍兴qw122(已下线)【浙江新东方】高中化学20210304-003(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)【镇江新东方】高二下21心湖期中安徽省淮北市树人高级中学2020-2021学年高一下学期期末考试化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第17讲 电解池 金属的腐蚀与防护(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)1.3 金属的腐蚀与防护(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)陕西省洛南县洛南中学2022届高三上学期第一次模拟考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)天津市和平区2021-2022学年高二上学期线上期末质量检测化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题06 电化学原理应用—2022年高考化学二轮复习讲练测(全国版)-测试天津市红桥区2020-2021学年高三上学期期末考试化学试题江苏省泰州中学2021-2022学年高二上学期第二次质量检测化学试题河北省邯郸市大名县第一中学2021-2022学年高一下学期第一次月考化学试题河北省邯郸市永年区第二中学2021-2022学年高一下学期第一次月考化学试题河北省保定市唐县第一中学2021-2022学年高一下学期6月考试化学试题(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题11 金属的腐蚀与防护-备战2023年高考化学母题题源解密(广东卷)第四章 综合拔高练(已下线)第17讲 电解池 金属的腐蚀与防护 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第17讲 电解池 金属的腐蚀与防护 (练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省六校2023届高三上学期开学考试化学试题(已下线)专题十一 化学能与电能-实战高考·二轮复习核心突破吉林省吉林市第一中学2022-2023学年高二上学期期末测试化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型106 金属的腐蚀与防护(已下线)专题六 金属的化学腐蚀与防护(练习)(已下线)专题12 电化学的综合应用广东省惠州市惠东县2022-2023学年高三上学期第二次教学质量检测化学试题(已下线)2019年高考江苏卷化学试题变式题(单选题6-10)(已下线)第25讲电解池与金属的电化学腐蚀(已下线)第4讲 电解池 金属的电化学腐蚀与防护河北省石家庄市辛集市育才中学2023-2024学年高三上学期12月月考化学试题



