解题方法
1 . 中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩渺星辰的征途。
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的___________ 极, 向
向___________ (填“正”或“负”)极作定向移动,Y极的电极反应式为___________ 。
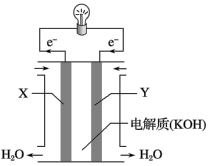
(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲制得常温下180g水,则电池内电子转移的物质的量约为___________ mol
(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将___________ 转化为___________ ,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为: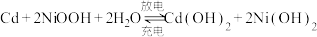 ,充电时,阳极的电极反应式为
,充电时,阳极的电极反应式为___________ ;
②当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性___________ (填“增大”“减小”或“不变”)。
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的
 向
向
(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲制得常温下180g水,则电池内电子转移的物质的量约为
(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将
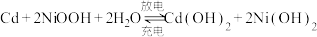 ,充电时,阳极的电极反应式为
,充电时,阳极的电极反应式为②当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性
您最近一年使用:0次
2 . 研发二氧化碳的碳捕捉和碳利用有着十分重要的现实意义。一定条件下能发生:CO2(g)+CH4(g) 2CO(g)+2H2(g) △H。
2CO(g)+2H2(g) △H。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802.3kJ•mol-1
C(s)+2H2O(g)=CO(g)+H2(g) △H2=+131.3kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ•mol-1
则上述反应体系的反应热△H=_______ kJ•mol-1。
(2)对于上述反应体系,下列说法正确的是_______ 。
(3)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0mol•L-1,测得CH4的平衡转化率与温度及压强的关系如图所示。

①压强p1、p2、p3、p4由小到大的关系为______ 。
②压强为p4时,在b点:v正_______ v逆(填“<”或“=”或“>”)。
③若p4=3MPa,则1100℃时,该反应的平衡常数Kp=______ (MPa)2。
(4)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极B上的电极反应式为______ 。
②若生成乙烷和乙烯的物质的量之比为2:1,则消耗CH4和CO2的物质的量之比为______ 。
 2CO(g)+2H2(g) △H。
2CO(g)+2H2(g) △H。(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802.3kJ•mol-1
C(s)+2H2O(g)=CO(g)+H2(g) △H2=+131.3kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ•mol-1
则上述反应体系的反应热△H=
(2)对于上述反应体系,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率也增大 |
| B.恒容密闭容器中,当气体密度不变时,反应达到平衡状态 |
| C.加入合适催化剂,可提滴CH4的平衡转化率 |
| D.v正(H2)=2v逆(CH4)时,反应体系处于平衡状态 |

①压强p1、p2、p3、p4由小到大的关系为
②压强为p4时,在b点:v正
③若p4=3MPa,则1100℃时,该反应的平衡常数Kp=
(4)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极B上的电极反应式为
②若生成乙烷和乙烯的物质的量之比为2:1,则消耗CH4和CO2的物质的量之比为
您最近一年使用:0次
名校
3 . 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:方法一:氨热分解法制氢气。
相关化学键的键能数据
(1)反应

______ kJ/mol
(2)已知反应的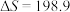 J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
(3)298 K时,1 g H2燃烧生成 放热121 kJ,1 mol
放热121 kJ,1 mol  蒸发吸热44 kJ,表示
蒸发吸热44 kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为____________________ 。
方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:
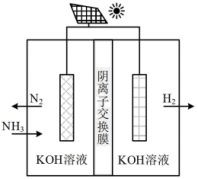
(4)电解过程中 的移动方向为
的移动方向为______ (填“从左往右”或“从右往左)
(5)阳极的电极反应式为__________________ 。
Ⅱ. 可用于高效制取氢气,发生的反应为
可用于高效制取氢气,发生的反应为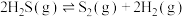 。
。
若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
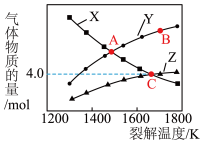
(6)图中曲线Z表示的物质是______ (填化学式)。
(7)C点时 的转化率为
的转化率为______ %(保留一位小数)。
(8)A点时,设容器内的总压为p Pa,则平衡常数
______ Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:方法一:氨热分解法制氢气。
相关化学键的键能数据
| 化学键 |  |  |  |
| 键能E/(KJ/mol) | 946 | 436 | 391 |


(2)已知反应的
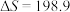 J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)
J∙mol-1∙K-1,在下列哪些温度下,反应能自发进行?_______(填标号)| A.25℃ | B.125℃ | C.225℃ | D.325℃ |
 放热121 kJ,1 mol
放热121 kJ,1 mol  蒸发吸热44 kJ,表示
蒸发吸热44 kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:

(4)电解过程中
 的移动方向为
的移动方向为(5)阳极的电极反应式为
Ⅱ.
 可用于高效制取氢气,发生的反应为
可用于高效制取氢气,发生的反应为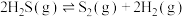 。
。若起始时容器中只有
 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
(6)图中曲线Z表示的物质是
(7)C点时
 的转化率为
的转化率为(8)A点时,设容器内的总压为p Pa,则平衡常数

您最近一年使用:0次
4 . 实验是化学研究的重要手段,定性与定量是实验研究的两个不同角度。
(1)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如图实验装置。

①甲装置中Co电极附近产生气泡,Co电极的电极反应式为___________ 。
②丙装置中X电极附近溶液先变红,X电极名称为___________ 极,反应一段时间后,可制得NaClO消毒液,丙装置中的总化学反应方程式为___________ 。
③三种金属的活动性由强到弱的顺序是___________ 。
(2)为了测定市售白醋的总酸量(g/100mL),某实验小组设计如下实验流程。

①“量取白醋样品10.00mL”用到的量取仪器是___________ ,“配制100mL待测白醋溶液”用到的仪器有烧杯、玻璃棒和___________ 。
②用0.1mol/L的NaOH标准液进行“酸碱中和滴定”,实验记录如下
该市售白醋总酸量=___________ g/100mL。
③“酸碱中和滴定”过程中,下列操作会使实验结果偏大的是___________ 。
A.未用标准NaOH溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(1)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如图实验装置。

①甲装置中Co电极附近产生气泡,Co电极的电极反应式为
②丙装置中X电极附近溶液先变红,X电极名称为
③三种金属的活动性由强到弱的顺序是
(2)为了测定市售白醋的总酸量(g/100mL),某实验小组设计如下实验流程。

①“量取白醋样品10.00mL”用到的量取仪器是
②用0.1mol/L的NaOH标准液进行“酸碱中和滴定”,实验记录如下
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(待测白醋)mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗)mL | 15.95 | 15.00 | 15.05 | 14.95 |
③“酸碱中和滴定”过程中,下列操作会使实验结果偏大的是
A.未用标准NaOH溶液润洗滴定管
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加入少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
您最近一年使用:0次
解题方法
5 . 化学能可以与其他形式的能量发生相互转化。
Ⅰ.化学能与热能的相互转化
(1)在25℃和101 kPa下, 和
和 反应生成
反应生成 时,放出483.6 kJ的热量。
时,放出483.6 kJ的热量。
①断裂1 mol H—H键需要吸收436 kJ的能量,断裂1 mol H—O键需要吸收463 kJ的能量。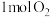 中的化学键断裂需要吸收的能量为
中的化学键断裂需要吸收的能量为_______ 。
②已知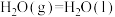
 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
(2)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为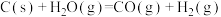
 。
。
已知:
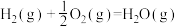

① 和
和 具有的总能量
具有的总能量_______ (填“大于”“等于”或“小于”)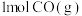 和
和 具有的总能量。
具有的总能量。
②理论上将煤转化为水煤气再燃烧放出的热量_______ (填“大于”“等于”或“小于”)直接燃烧煤放出的热量。
Ⅱ.化学能与电能的相互转化
(3)实验室制作简单的氢氧燃料电池示意图如下图(a)所示。

①闭合 ,一段时间后,
,一段时间后,_______ (填“阳”或“阴”)极区附近的溶液变红。
②断开 ,闭合
,闭合 。电路中每通过2 mol电子,消耗氢气的体积为
。电路中每通过2 mol电子,消耗氢气的体积为_______ (转换为标准状况下的体积)。
(4)离子膜电解法常用于制备金属氧化物或金属氧化物的前驱体。一种电解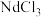 溶液制备难溶物
溶液制备难溶物 的装置示意图如图(b)所示。
的装置示意图如图(b)所示。

①为了获得更多的 ,应选用
,应选用_______ (填“阳”或“阴”)离子交换膜。
②电极B的电极反应式为_______ 。
Ⅰ.化学能与热能的相互转化
(1)在25℃和101 kPa下,
 和
和 反应生成
反应生成 时,放出483.6 kJ的热量。
时,放出483.6 kJ的热量。①断裂1 mol H—H键需要吸收436 kJ的能量,断裂1 mol H—O键需要吸收463 kJ的能量。
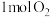 中的化学键断裂需要吸收的能量为
中的化学键断裂需要吸收的能量为②已知
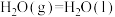
 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为
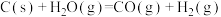
 。
。已知:

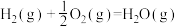

①
 和
和 具有的总能量
具有的总能量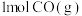 和
和 具有的总能量。
具有的总能量。②理论上将煤转化为水煤气再燃烧放出的热量
Ⅱ.化学能与电能的相互转化
(3)实验室制作简单的氢氧燃料电池示意图如下图(a)所示。

①闭合
 ,一段时间后,
,一段时间后,②断开
 ,闭合
,闭合 。电路中每通过2 mol电子,消耗氢气的体积为
。电路中每通过2 mol电子,消耗氢气的体积为(4)离子膜电解法常用于制备金属氧化物或金属氧化物的前驱体。一种电解
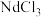 溶液制备难溶物
溶液制备难溶物 的装置示意图如图(b)所示。
的装置示意图如图(b)所示。
①为了获得更多的
 ,应选用
,应选用②电极B的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
|
解题方法
6 . 化学上把外加少量酸或碱仍能保持pH值基本不变的溶液称为缓冲溶液。
(1)下列物质能配制成缓冲溶液的是_____ (填序号)。
a.HCl-NaCl b.Na2CO3-NaHCO3
c.NH3·H2O-NH4Cl d.KOH-KCl
(2)现将0.02mol/LHA溶液和0.01mol/LNaOH溶液等体积混合,得到缓冲溶液。若该缓冲溶液显碱性,则溶液中c(Na+)______ c(A-)(填“<”“=”或“>”)。
(3)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是_____ (填写选项字母)。
a.代谢产生的H+被HCO 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H2CO3中和转化为HCO
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.代谢产生的碱被H+中和,H+又由H2CO3电离补充
(4)在正常体温时,人体血液中H2CO3的一级电离常数Ka1=10-6.1,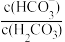 ≈
≈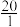 ,lg2=0.3。由题给数据可算得正常人体血液的pH约为
,lg2=0.3。由题给数据可算得正常人体血液的pH约为_____ ,当过量的酸进入血液中时,血液缓冲体系中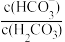 的值将
的值将_____ (填“增大”“减小”或“不变”)。
(5)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如图所示。电池的总反应如下:

Zn+2VOSO4+2H2SO4 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO ;V2(SO4)3=2V3++3SO
;V2(SO4)3=2V3++3SO
①放电时,B室中c(H+)_____ (填“增大”“减小”或“不变”),结合化学用语说明理由______ 。
②充电时,A室中的c(H+)变化缓慢的原因是_____ 。
(1)下列物质能配制成缓冲溶液的是
a.HCl-NaCl b.Na2CO3-NaHCO3
c.NH3·H2O-NH4Cl d.KOH-KCl
(2)现将0.02mol/LHA溶液和0.01mol/LNaOH溶液等体积混合,得到缓冲溶液。若该缓冲溶液显碱性,则溶液中c(Na+)
(3)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是
a.代谢产生的H+被HCO
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H2CO3中和转化为HCO

c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.代谢产生的碱被H+中和,H+又由H2CO3电离补充
(4)在正常体温时,人体血液中H2CO3的一级电离常数Ka1=10-6.1,
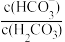 ≈
≈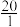 ,lg2=0.3。由题给数据可算得正常人体血液的pH约为
,lg2=0.3。由题给数据可算得正常人体血液的pH约为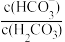 的值将
的值将(5)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如图所示。电池的总反应如下:

Zn+2VOSO4+2H2SO4
 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO
 ;V2(SO4)3=2V3++3SO
;V2(SO4)3=2V3++3SO
①放电时,B室中c(H+)
②充电时,A室中的c(H+)变化缓慢的原因是
您最近一年使用:0次
解题方法
7 . 利用电解法将CO2转化为CH4的原理如图所示。下列说法不正确 的是
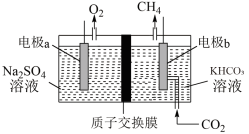
| A.电解过程中,H+由a极区向b极区迁移 |
| B.电解时Na2SO4溶液浓度保持不变 |
| C.当电路中转移4mol电子时,标况下阳极产生22.4LO2 |
D.电极b上反应为CO2+8HCO +8e-=CH4+8CO +8e-=CH4+8CO +2H2O +2H2O |
您最近一年使用:0次
2023-02-22更新
|
278次组卷
|
3卷引用:广东省大湾区2022-2023学年高二上学期期末联考化学试题
解题方法
8 . 可充电水系Zn-LVP电池用锌和 作两极,电池工作示意图如图所示,下列有关该电池的说法正确的是
作两极,电池工作示意图如图所示,下列有关该电池的说法正确的是
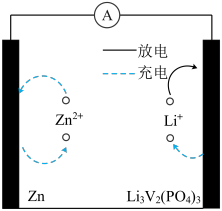
 作两极,电池工作示意图如图所示,下列有关该电池的说法正确的是
作两极,电池工作示意图如图所示,下列有关该电池的说法正确的是
| A.放电时,当电路中转移1 mol电子时,正极材料增重7g |
B.放电时, 作正极,发生氧化反应 作正极,发生氧化反应 |
C.充电时,电子从 电极经电解液流向锌电极 电极经电解液流向锌电极 |
D.充电时,电池总反应为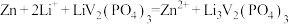 |
您最近一年使用:0次
解题方法
9 . 据报道,最近有科学家设计了一种在常压下运行的集成 基质子陶瓷膜反应器(PCMR),将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法不正确的是
基质子陶瓷膜反应器(PCMR),将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法不正确的是

 基质子陶瓷膜反应器(PCMR),将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法不正确的是
基质子陶瓷膜反应器(PCMR),将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法不正确的是
A.阴极可能发生副反应: |
B.阳极的电极反应式: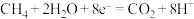 |
C.质子 通过交换膜由阳极区向阴极区移动 通过交换膜由阳极区向阴极区移动 |
D.理论上电路中通过 电子时,阴极最多产生 电子时,阴极最多产生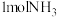 |
您最近一年使用:0次
名校
10 . 钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。电解 水溶液中制备金属Co的装置如图所示。下列说法不正确的是
水溶液中制备金属Co的装置如图所示。下列说法不正确的是
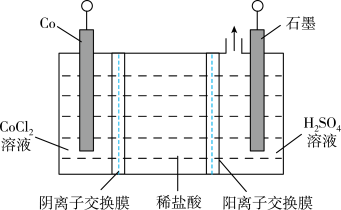
 水溶液中制备金属Co的装置如图所示。下列说法不正确的是
水溶液中制备金属Co的装置如图所示。下列说法不正确的是
| A.Co电极接电源的负极 |
B.电解时 溶液的pH增大 溶液的pH增大 |
| C.电解后盐酸溶液的浓度增大 |
| D.每生成0.1 mol Co,石墨电极上会析出1.12 L(标准状况)气体 |
您最近一年使用:0次
2023-01-09更新
|
313次组卷
|
2卷引用:广东省广州市第二中学2022-2023学年高二上学期期末考试化学试题



