名校
解题方法
1 . 商务部、海关总署在官网发布公告称,决定对镓、锗相关物项实施出口管制。锗,天然的优良半导体,在光纤通信、红外光学、太阳能电池、核物理探测等领域应用颇多。工业上利用锗锌矿(主要成分为GeO2和ZnS,还含少量Fe2O3 )来制备高纯度锗的流程如图。
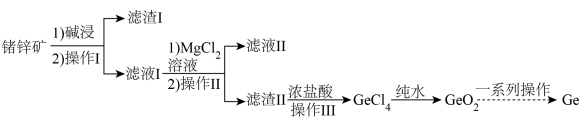
已知:①GeCl4的熔点为-49.5℃ ,沸点为84℃,其在水中或酸的稀溶液中易水解。
②GeO2可溶于强碱溶液,生成锗酸盐。
(1)在元素周期表中,Ge、As、Se位于同一周期,则基态原子的第一电离能由大到小的顺序是________ 。
(2)硅和锗与氯元素都能形成氯化物RCL(R代表Si和Ge),从原子结构角度解释原因:___ 。
(3)“滤渣II”中除含有MgGeO3外,还含有少量____________ (填化学式)。
(4)GeCl4中加水反应的离子方程式是______________ 。
(5)固态GeCl4为_______ 晶体,“操作III”分离获得GeCl4所使用的装置为________ (填标号)。
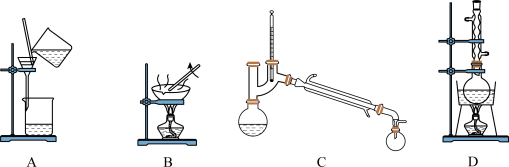
根据选择,提出改进的方法:_________ (若不需要改进,此空填“不需要")。
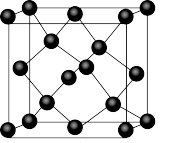
(6)Ge单晶的晶胞结构类似于金刚石,如图。已知Ge单晶的晶胞边长为a pm,设NA为阿伏加德罗常数的值,Ge单晶的密度为______ g·cm-3。

已知:①GeCl4的熔点为-49.5℃ ,沸点为84℃,其在水中或酸的稀溶液中易水解。
②GeO2可溶于强碱溶液,生成锗酸盐。
(1)在元素周期表中,Ge、As、Se位于同一周期,则基态原子的第一电离能由大到小的顺序是
(2)硅和锗与氯元素都能形成氯化物RCL(R代表Si和Ge),从原子结构角度解释原因:
(3)“滤渣II”中除含有MgGeO3外,还含有少量
(4)GeCl4中加水反应的离子方程式是
(5)固态GeCl4为

根据选择,提出改进的方法:
(6)Ge单晶的晶胞结构类似于金刚石,如图。已知Ge单晶的晶胞边长为a pm,设NA为阿伏加德罗常数的值,Ge单晶的密度为

您最近一年使用:0次
2 . 以钴铜矿 主要成分为
主要成分为 、
、 、
、 ,另含少量
,另含少量 及含砷化合物
及含砷化合物 制备锂电池正极原料
制备锂电池正极原料 ,生产流程如图所示。
,生产流程如图所示。

已知: 酸浸液中阳离子为
酸浸液中阳离子为 、
、 、
、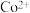 、
、
 萃取铜的过程可表示为
萃取铜的过程可表示为 有机物
有机物 有机物
有机物
 ,
,
(1)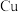 在周期表中的位置为
在周期表中的位置为__________ , 中
中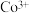 的价电子排布式为
的价电子排布式为__________________ 。
(2)酸浸液中钴以 形式存在,生成
形式存在,生成 的化学方程式为
的化学方程式为______________ 。酸浸过程可适当升温以加快反应速率,但温度过高,单位时间内钴的浸出率明显降低,原因是_____________ 。
(3)在除铁过程中,溶液中的 转化为
转化为 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为 ___________ 。常温条件下若除铁结束后溶液 ,则
,则 是否被完全沉淀
是否被完全沉淀 浓度低于
浓度低于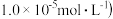 ,通过计算说明
,通过计算说明____________________________ 。
(4)焙烧过程中,若空气与 接触不充分,废气中会含有
接触不充分,废气中会含有______  填化学式
填化学式 污染空气,需要进行净化后再排放。
污染空气,需要进行净化后再排放。
 主要成分为
主要成分为 、
、 、
、 ,另含少量
,另含少量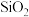 及含砷化合物
及含砷化合物 制备锂电池正极原料
制备锂电池正极原料 ,生产流程如图所示。
,生产流程如图所示。
已知:
 酸浸液中阳离子为
酸浸液中阳离子为 、
、 、
、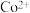 、
、
 萃取铜的过程可表示为
萃取铜的过程可表示为 有机物
有机物 有机物
有机物
 ,
,
(1)
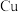 在周期表中的位置为
在周期表中的位置为 中
中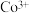 的价电子排布式为
的价电子排布式为(2)酸浸液中钴以
 形式存在,生成
形式存在,生成 的化学方程式为
的化学方程式为(3)在除铁过程中,溶液中的
 转化为
转化为 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为  ,则
,则 是否被完全沉淀
是否被完全沉淀 浓度低于
浓度低于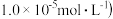 ,通过计算说明
,通过计算说明(4)焙烧过程中,若空气与
 接触不充分,废气中会含有
接触不充分,废气中会含有 填化学式
填化学式 污染空气,需要进行净化后再排放。
污染空气,需要进行净化后再排放。
您最近一年使用:0次
名校
解题方法
3 . 硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________ ,第二周期第一电离能比B高的元素有_______ 种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________ ,写出[BH4]-的两种等电子体_____________________ 。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________ (以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________ 。
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________ ;同一片层划分出的一个二维晶胞(平行四边形)含有_______ 个H3BO3分子。
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________

(1)基态B原子的价电子轨道表达式为
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为
| 图1 | 图2 | 图3 |
 |  |  |
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:

您最近一年使用:0次
2018-04-27更新
|
903次组卷
|
3卷引用:【全国百强校】湖北省襄阳市第五中学2018届高三五月模拟考试(一)理综化学试题
12-13高三·湖北襄阳·阶段练习
4 . VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是______ 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______ 。
(3)As原子序数为__ ,其核外M层和N层电子的排布式为__ 。
(4)NH3的沸点比PH3___ (填“高”或“低”),原因是__ ,PO 离子的立体构型为
离子的立体构型为___ 。
(5)H3PO4的K1、K2、K3分别为7.6×10﹣3、6.3×10﹣8、4.4×10﹣13.硝酸完全电离,而亚硝酸K=5.1×10﹣4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因___ ;
②硝酸比亚硝酸酸性强的原因___ ;
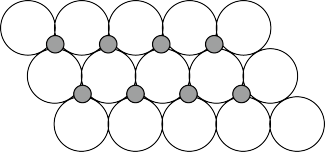
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为__ cm(用含有a的代数式表示),在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为__ g(氧离子的半径为1.40×10﹣10m)。
(1)白磷单质的中P原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为
(3)As原子序数为
(4)NH3的沸点比PH3
 离子的立体构型为
离子的立体构型为(5)H3PO4的K1、K2、K3分别为7.6×10﹣3、6.3×10﹣8、4.4×10﹣13.硝酸完全电离,而亚硝酸K=5.1×10﹣4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因
②硝酸比亚硝酸酸性强的原因
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为

您最近一年使用:0次
名校
5 . 原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________ 。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______ (填化学式),呈现如此递变规律的原因是________________________________ 。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___ ,另一种的晶胞如图二所示,该晶胞的空间利用率为________________ (保留两位有效数字)。(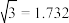 )
)
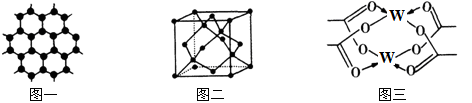
(4)W元素形成的单质,其晶体的堆积模型为___________ ,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________ 。请写出上述过程的离子方程式___________________________ ,___________________________________ 。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
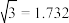 )
)
(4)W元素形成的单质,其晶体的堆积模型为
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是
您最近一年使用:0次
2016-12-08更新
|
1333次组卷
|
4卷引用:2015届湖北省仙桃天门潜江高三上学期期末联考理综化学试卷



