解题方法
1 . 【化学---选修3:物质结构与性质】“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过______ 相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为________ (填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为________________ 。
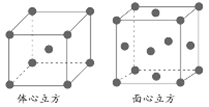
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________ 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
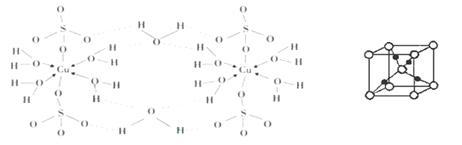
①写出基态Cu2+的核外电子排布式_______ 。
②胆矾中含有的粒子间作用力是_______ (填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为_______ 。
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是_____ 。
(1)水分子间通过
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
①基态铬原子的电子排布式为
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为

(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:

①写出基态Cu2+的核外电子排布式
②胆矾中含有的粒子间作用力是
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是
您最近一年使用:0次
2016-12-09更新
|
433次组卷
|
3卷引用:2015届云南省弥勒市高三市统测一模理综化学试卷
2 . A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B_______ ,G_______ 。
(2)写出F的价电子排布图:_______ 。
(3)写出化合物BC的结构式:__________________ 。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是________________ 。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是______________________ 。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有_______ 个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为____ pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)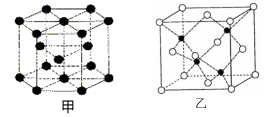
(1)写出元素名称:B
(2)写出F的价电子排布图:
(3)写出化合物BC的结构式:
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是
(6)E的一种晶体结构如图甲,则其一个晶胞中含有
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)

您最近一年使用:0次
2016-12-09更新
|
888次组卷
|
5卷引用:云南省元阳县第一中学2020届高三上学期开学考试化学试题
云南省元阳县第一中学2020届高三上学期开学考试化学试题云南省凤庆县一中2020届高三上学期开学考试理综化学试题(已下线)2014届吉林省吉林市高三下学期第二次模拟考试理综化学试卷(已下线)2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷贵州省平塘县民族中学2020届高三上学期开学考试(理综)化学试题
2014·全国·一模
名校
解题方法
3 . A、B、C、D、E、F六种元素的原子序数依次增大。A的最高正价和最低负价的绝对值相等。B的基态原子有3个不同的能级且各能级中电子数相等。D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为_______ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为___ 。(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是________
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有____________ 。
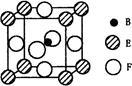
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示。B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为_______ ,该晶体的化学式为____________ 。若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,,则该晶体的密度表达式为_______ g·cm-3。
(1)F的基态原子价电子排布式为
(2)B、C、D、E的原子的第一电离能由小到大的顺序为
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示。B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为

您最近一年使用:0次
2014·云南红河·一模
解题方法
4 . 已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为______ 。
(2)B、C、D的第一电离能由小到大的顺序为______ 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是______ 。
(4)E的最高价氧化物分子的空间构型是______ 。其中心原子的杂化方式为______ 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为______ 。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为______ ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为______ g/cm3。

回答下列问题:
(1)F的原子的M层电子排布式为
(2)B、C、D的第一电离能由小到大的顺序为
(3)A的简单氢化物分子极易溶于水,其主要原因是
(4)E的最高价氧化物分子的空间构型是
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为

您最近一年使用:0次
2016-12-09更新
|
720次组卷
|
4卷引用:2014届云南省红河州高中毕业生复习统一检测理综化学试卷
(已下线)2014届云南省红河州高中毕业生复习统一检测理综化学试卷(已下线)2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷2016届内蒙古赤峰市宁城县高三上学期第一次统考化学试卷2017届内蒙古赤峰市宁城县高三上统一考试化学试卷
13-14高三上·湖北襄阳·阶段练习
解题方法
5 . 请回答以下问题:
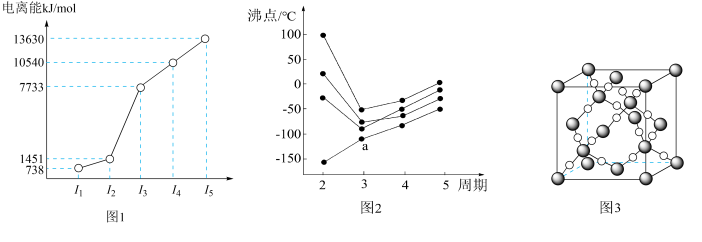
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为___________ 。
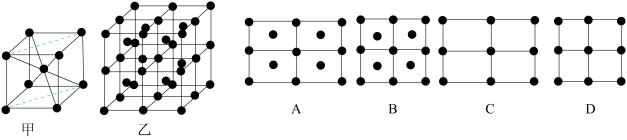
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ 。简述你的判断依据___________ 。
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的类型属于___________ (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为___________ 。
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为___________ 。
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是___________ 。铁原子的配位数是___________ ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为___________ (设阿伏加德罗常数的值为NA)。
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的类型属于

(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是

您最近一年使用:0次
12-13高三·贵州·阶段练习
名校
6 . 下面是C60、金刚石和二氧化碳的分子模型。
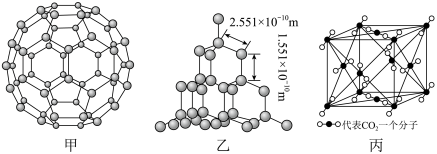
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________ 晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________ ;晶体硅中硅原子与共价键的个数比为____________
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________ 个二氧化碳分子,二氧化碳分子中 键与
键与 键的个数比为
键的个数比为________________ 。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______ ,丙烯分子中2号碳原子的杂化方式是_______ ,丙烯分子中最多有______ 个原子共平面。

请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:
(2)从晶体类型来看,C60属于
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有
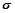 键与
键与 键的个数比为
键的个数比为(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是
您最近一年使用:0次
2016-12-09更新
|
961次组卷
|
4卷引用:云南省澄江市第一中学2021-2022学年高三下学期3月月考理综化学试题
2010·黑龙江·模拟预测
名校
解题方法
7 . 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍。X原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为_______________ 。
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为_____________ ,根据价层电子对互斥理论预测BA2D的分子构型为____________ 。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)________
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
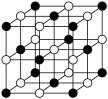
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是______________ 。MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有__________________ 个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__________________ 。
(1)写出C、D、E三种原子第一电离能由大到小的顺序为
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是
您最近一年使用:0次
2016-12-09更新
|
722次组卷
|
5卷引用:云南省泸水五中2018-2019学年高二上学期期中考试化学试题
云南省泸水五中2018-2019学年高二上学期期中考试化学试题(已下线)2010年黑龙江省哈九中高三第四次高考模拟考试化学试题(已下线)2011届吉林省延吉市汪清六中高三第六次月考(理综)化学部分贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题
14-15高三上·云南玉溪·阶段练习
解题方法
8 . 【化学——选修3:物质结构与性质】
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_______________________ ,CO有多种等电子体,其中常见的一种分子是________ 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____ 个δ键,C原子的杂化方式为______ 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是____________ ,形成的化学键是_______________ 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
写出A原子的电子排布图__________________ ,Al原子的第一电离能______ 填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是________________________ 。
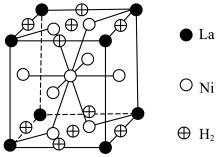
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为_______ 。
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为

您最近一年使用:0次



