1 . 比较下列能级的能量大小关系(填“>”“=”或“<”):
(1)2s_______ 4s;
(2)3p_______ 3d;
(3)3d_______ 4s;
(4)4d_______ 5d;
(5)2p_______ 3s;
(6)4d_______ 5f。
(1)2s
(2)3p
(3)3d
(4)4d
(5)2p
(6)4d
您最近一年使用:0次
2 . 电离能的应用
(1)根据电离能数据,确定元素原子核外电子的排布及元素的化合价。如Li:I1≪I2<I3,表明Li原子核外的_______ 个电子排布在两个能层上(K、L能层),且最外层上只有一个电子,易失去_______ 形成_______ 阳离子。
(2)判断元素的金属性、非金属性强弱:I1越_______ ,元素的非金属性越_______ ;I1越小,元素的金属性越_______ 。
(1)根据电离能数据,确定元素原子核外电子的排布及元素的化合价。如Li:I1≪I2<I3,表明Li原子核外的
(2)判断元素的金属性、非金属性强弱:I1越
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
3 . 应用
①判断元素的金属性和非金属性强弱
i.金属的电负性一般_______ 1.8,非金属的电负性一般_______ 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在_______ 左右,它们既有金属性,又有非金属性。
ii.金属元素的电负性_______ ,金属元素越活泼;非金属元素的电负性_______ ,非金属元素越活泼。
②判断元素的化合价
i.电负性数值小的元素在化合物中吸引电子的能力_______ ,元素的化合价为_______ 。
ii.电负性数值大的元素在化合物中吸引电子的能力_______ ,元素的化合价为_______ 。
③判断化合物的类型

如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为3.0-1.5=1.5<1.7,因此AlCl3为共价化合物;同理,BeCl2也是共价化合物。
注意:电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性之差为1.9,但HF为共价化合物。
①判断元素的金属性和非金属性强弱
i.金属的电负性一般
ii.金属元素的电负性
②判断元素的化合价
i.电负性数值小的元素在化合物中吸引电子的能力
ii.电负性数值大的元素在化合物中吸引电子的能力
③判断化合物的类型

如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为3.0-1.5=1.5<1.7,因此AlCl3为共价化合物;同理,BeCl2也是共价化合物。
注意:电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性之差为1.9,但HF为共价化合物。
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
4 . 同周期、同主族元素性质的递变规律
| 性质 | 同一周期(从左到右) | 同一主族(从上到下) | |
| 核外电子的排布 | 能层数 | ||
| 最外层电子数 | 1→2或8 | ||
| 金属性 | |||
| 非金属性 | |||
| 单质的氧化性、还原性 | 氧化性 | ||
| 还原性 | |||
| 最高价氧化物对应水化物的酸碱性 | 酸性 | ||
| 碱性 | |||
| 气态氢化物的稳定性 | |||
| 第一电离能 | |||
| 电负性 | |||
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
5 . 元素第一电离能的概念与意义
(1)概念
①第一电离能:_______ 电中性_______ 原子失去一个电子转化为_______ 正离子所需要的_______ 叫做第一电离能,符号:_______ 。
②逐级电离能:气态基态_______ 价正离子再_______ 一个电子成为气态基态_______ 价正离子所需的最低能量叫做第二电离能,第三电离能和第四、第五电离能依此类推。由于原子失去电子形成离子后,若再失去电子会更加_______ ,因此同一原子的各级电离能之间存在如下关系:I1<I2<I3……
(2)意义:可以衡量元素的原子_______ 一个电子的_______ 程度。第一电离能数值越_______ ,原子越_______ 失去一个电子;第一电离能数值越_______ ,原子越_______ 失去一个电子。
(1)概念
①第一电离能:
②逐级电离能:气态基态
(2)意义:可以衡量元素的原子
您最近一年使用:0次
21-22高二下·全国·单元测试
6 . 解题技巧:电离能的应用
①根据电离能数据,确定元素在化合物中的化合价,如K:I1≪I2<I3,表明K原子易失去一个电子形成+1价阳离子。
②判断元素的金属性、非金属性强弱:I1越_______ ,元素的非金属性越_______ ;I1越_______ ,元素的金属性越_______ 。
①根据电离能数据,确定元素在化合物中的化合价,如K:I1≪I2<I3,表明K原子易失去一个电子形成+1价阳离子。
②判断元素的金属性、非金属性强弱:I1越
您最近一年使用:0次
7 . 能量最低原理
(1)内容:在构建基态原子时,电子将尽可能地占据_______ 的原子轨道,使整个原子的能量最_______ 。
(2)因素:整个原子的能量由_______ 、_______ 和_______ 三个因素共同决定。
(1)内容:在构建基态原子时,电子将尽可能地占据
(2)因素:整个原子的能量由
您最近一年使用:0次
21-22高二下·全国·单元测试
8 . 元素周期表探究
①元素周期表的结构

②元素周期表的分区
i.根据核外电子的排布分区
按电子排布式中最后填入电子的_______ 符号可将元素周期表分为s、p、d、f 4个区,而ⅠB、ⅡB族这2个纵行的元素的核外电子因先填满了_______ 能级而后再填充ns能级而得名_______ 区。5个区的位置关系如图所示。
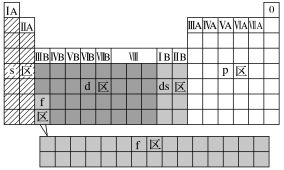
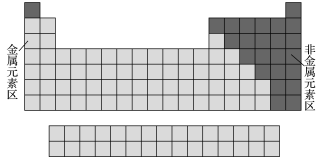
ii.根据元素的金属性和非金属性分区
①元素周期表的结构

②元素周期表的分区
i.根据核外电子的排布分区
按电子排布式中最后填入电子的

ii.根据元素的金属性和非金属性分区

您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
9 . 氮氧化铝(AlON)是新型透明高硬度防弹铝材料,属于共价晶体,主要用于装甲车辆防弹窗户、战场光学设备的透镜、望远镜穹顶以及覆盖于导弹传感器顶部的透明圆窗等。下列描述错误的是
| A.基态铝原子的价电子排布式为3s23p1 |
| B.制备AlON的原料N2中N原子采取sp2杂化 |
| C.AlON和水晶的化学键类型相同 |
| D.AlON的熔点比AlCl3的熔点高 |
您最近一年使用:0次
21-22高二下·全国·单元测试
10 . 硼砂是含结晶水的四硼酸钠,请根据模型回答有关问题:
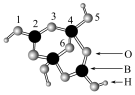
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中的2号硼原子的价层电子对数为_____ ;m=_____ (填数字)。
(2)硼可以与氮形成BN,其中B的化合价为_____ ,请解释原因:_____ 。
(3)BF3和过量NaF作用可生成NaBF4,BF 的空间结构为
的空间结构为_____ ;NaBF4的电子式为_____ 。

(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中的2号硼原子的价层电子对数为
(2)硼可以与氮形成BN,其中B的化合价为
(3)BF3和过量NaF作用可生成NaBF4,BF
 的空间结构为
的空间结构为
您最近一年使用:0次



