1 . 按要求完成下列问题。
(1) 在水中的溶解度是常见气体中最大的。下列因素与
在水中的溶解度是常见气体中最大的。下列因素与 的水溶性没有关系的是
的水溶性没有关系的是_______ 。
a. 和
和 都是极性分子
都是极性分子
b. 在水中易形成氢键
在水中易形成氢键
c. 溶于水建立了以下平衡:
溶于水建立了以下平衡: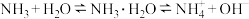
d. 是一种易液化的气体
是一种易液化的气体
(2) 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断 是
是_______ (填“极性”或“非极性”)分子。
(3)在①苯、② 、③HCHO、④
、③HCHO、④ 、⑤
、⑤ 五种有机溶剂中,碳原子采取
五种有机溶剂中,碳原子采取 杂化的分子有
杂化的分子有_______ (填序号), 分子的立体构型是
分子的立体构型是_______ 。 与
与 相比,
相比,_______ 的熔点较高。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体 ,呈正四面体构型。
,呈正四面体构型。 易溶于下列
易溶于下列_______ (填字母)
a.水 b. c.
c. (苯) d.
(苯) d. 溶液
溶液
(5)甲醛、甲醇和甲酸等碳原子个数较少的醛、醇和羧酸均易溶于水,而甲烷、甲酸甲酯难溶于水,试解释其原因_______ 。
(1)
 在水中的溶解度是常见气体中最大的。下列因素与
在水中的溶解度是常见气体中最大的。下列因素与 的水溶性没有关系的是
的水溶性没有关系的是a.
 和
和 都是极性分子
都是极性分子b.
 在水中易形成氢键
在水中易形成氢键c.
 溶于水建立了以下平衡:
溶于水建立了以下平衡: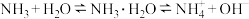
d.
 是一种易液化的气体
是一种易液化的气体(2)
 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断 是
是(3)在①苯、②
 、③HCHO、④
、③HCHO、④ 、⑤
、⑤ 五种有机溶剂中,碳原子采取
五种有机溶剂中,碳原子采取 杂化的分子有
杂化的分子有 分子的立体构型是
分子的立体构型是 与
与 相比,
相比,(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体
 ,呈正四面体构型。
,呈正四面体构型。 易溶于下列
易溶于下列a.水 b.
 c.
c. (苯) d.
(苯) d. 溶液
溶液(5)甲醛、甲醇和甲酸等碳原子个数较少的醛、醇和羧酸均易溶于水,而甲烷、甲酸甲酯难溶于水,试解释其原因
您最近一年使用:0次
2 . 很多含巯基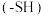 的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。___________ 。
(2)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(3)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________。
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是___________ 。
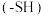 的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。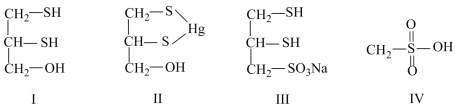
(2)H2S、CH4、H2O的沸点由高到低顺序为
(3)汞的原子序数为80,位于元素周期表第
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________。
A.在Ⅰ中 原子采取 原子采取 杂化 杂化 | B.在Ⅱ中 元素的电负性最大 元素的电负性最大 |
C.在Ⅲ中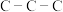 键角是180° 键角是180° | D.在Ⅲ中存在离子键与共价键 |
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是
您最近一年使用:0次
名校
3 . 回答下列问题
(1)铜及其化合物是化工生产、生活中常用的材料。
① 价层电子的轨道表达式为
价层电子的轨道表达式为__________ 。
② 为平面正方形结构,其中的两个
为平面正方形结构,其中的两个 被
被 取代后有两种不同的结构,画出
取代后有两种不同的结构,画出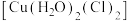 是非极性分子的结构为
是非极性分子的结构为__________ 。
③ 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角__________ (填“大”“小”或“相等”)。
④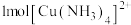 中存在
中存在__________ 个 键。
键。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 的晶体类型为
的晶体类型为__________ ,是__________ 分子(填“极性”或“非极性”)。
(3)氮化镓是一种新型半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。__________ 。
②若晶胞中Ga和N原子的最近距离为a pm,阿伏加德罗常数的值为 ,则氮化镓的晶体密度为
,则氮化镓的晶体密度为__________  (列出计算表达式)。
(列出计算表达式)。
(1)铜及其化合物是化工生产、生活中常用的材料。
①
 价层电子的轨道表达式为
价层电子的轨道表达式为②
 为平面正方形结构,其中的两个
为平面正方形结构,其中的两个 被
被 取代后有两种不同的结构,画出
取代后有两种不同的结构,画出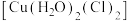 是非极性分子的结构为
是非极性分子的结构为③
 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角④
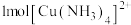 中存在
中存在 键。
键。(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 的晶体类型为
的晶体类型为(3)氮化镓是一种新型半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
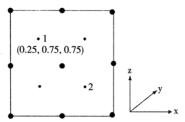
②若晶胞中Ga和N原子的最近距离为a pm,阿伏加德罗常数的值为
 ,则氮化镓的晶体密度为
,则氮化镓的晶体密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
4 . 丙二烯的结构简式为 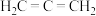 ,丙炔的结构简式为
,丙炔的结构简式为 ,它们是互变异构,存在互变平衡:
,它们是互变异构,存在互变平衡: 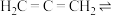
 ,该反应平衡常数很大。回答下列问题:
,该反应平衡常数很大。回答下列问题:
(1)碳原子基态最高能级电子云轮廓图为___________ 形,价电子轨道表达式为___________ 。
(2)丙二烯中碳原子的杂化方式为___________ ,1mol丙二烯含有σ键的数目为___________ 。
(3)下列说法正确的是___________(填标号)。
(4)已知3个或3个以上原子彼此平行的p轨道从侧面“肩并肩”重叠形成的π键叫大π键。则丙二烯分子中___________ (填“是”或“否”)存在大π键。
(5)查阅阿莱一罗周电负性表,可知电负性N为3.07,C1为2.83。
①NCl3分子的形状为___________ 。
②液态NCl3的水解反应属于非氧化还原反应,该水解反应的化学方程式为___________ 。
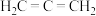 ,丙炔的结构简式为
,丙炔的结构简式为 ,它们是互变异构,存在互变平衡:
,它们是互变异构,存在互变平衡: 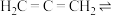
 ,该反应平衡常数很大。回答下列问题:
,该反应平衡常数很大。回答下列问题:(1)碳原子基态最高能级电子云轮廓图为
(2)丙二烯中碳原子的杂化方式为
(3)下列说法正确的是___________(填标号)。
| A.丙炔比丙二烯稳定 |
| B.丙炔中存在sp-sp2 σ键 |
| C.丙炔中所有原子一定不在同一平面上 |
| D.丙二烯分子“CH2”中∠HCH的精确值等于120° |
(5)查阅阿莱一罗周电负性表,可知电负性N为3.07,C1为2.83。
①NCl3分子的形状为
②液态NCl3的水解反应属于非氧化还原反应,该水解反应的化学方程式为
您最近一年使用:0次
名校
5 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下:
(1)第三周期主族元素中电负性比 小的元素有
小的元素有___________ 种, 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
(2) 和
和 均为
均为___________ 晶体, 的熔点为
的熔点为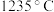 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是___________ 。
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示___________ 填化学式),图2中,A原子坐标参数为(0,0,0),B原子为 ,则C原子的坐标参数为
,则C原子的坐标参数为___________ 。
 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下: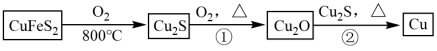
(1)第三周期主族元素中电负性比
 小的元素有
小的元素有 的沸点比
的沸点比 的
的(2)
 和
和 均为
均为 的熔点为
的熔点为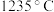 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,则C原子的坐标参数为
,则C原子的坐标参数为
您最近一年使用:0次
名校
6 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近一年使用:0次
2024-04-26更新
|
210次组卷
|
2卷引用:广西壮族自治区桂林市联考2023-2024学年高二下学期3月月考化学试题
名校
7 . 中学常见的有机物:乙烷、乙烯、溴乙烷、乙醇、苯酚、乙酸、乙酸乙酯。
(1)物质结构
①7种物质的分子中只含有 键的是
键的是___________ 。
②7种物质的分子中,所有原子一定都在同一平面的物质的结构简式为___________ 。
(2)物理性质
①常温下,溴乙烷的水溶性___________ (填“大于”、“等于”或“小于”)乙醇,原因可能是___________ 。
②下列烷烃的沸点从低到高的顺序为:___________ (用字母序号表示)。
a.异丁烷 b.正丁烷 c.乙烷 d.丙烷
(3)物质转化
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的反应如下:
 ①
①
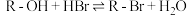 ②
②
有关数据列表如下:
①得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后再加入无水 ,然后进行的实验操作是
,然后进行的实验操作是___________ (填字母序号)。
a.分液 b.蒸馏 c.萃取
②将溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物在___________ (填“上层”、“下层”或“不分层”)。
③为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,进行下列操作:
①加热 ②加入 溶液 ③加入稀
溶液 ③加入稀 酸化 ④加入
酸化 ④加入 溶液
溶液
下列操作顺序合理的是___________ (填字母序号)。
a.①②③④ B.②③①④ C.④①③② d.①④②③
④在制备溴乙烷时,采用边反应边蒸出产物的方法,原因是___________ 。
(4)性质比较
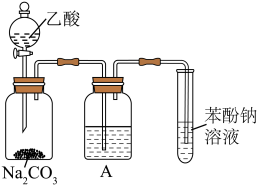
某同学用如图所示装置比较乙酸、苯酚、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊。___________ 。
② 中盛放的溶液是
中盛放的溶液是___________ 。
③苯酚钠溶液中发生反应的化学方程式为___________ 。
(1)物质结构
①7种物质的分子中只含有
 键的是
键的是②7种物质的分子中,所有原子一定都在同一平面的物质的结构简式为
(2)物理性质
①常温下,溴乙烷的水溶性
②下列烷烃的沸点从低到高的顺序为:
a.异丁烷 b.正丁烷 c.乙烷 d.丙烷
(3)物质转化
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的反应如下:
 ①
①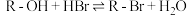 ②
②有关数据列表如下:
| 乙醇 | 溴乙烷 | |
密度/ | 0.7893 | 1.4604 |
沸点/ | 78.5 | 38.4 |
 ,然后进行的实验操作是
,然后进行的实验操作是a.分液 b.蒸馏 c.萃取
②将溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物在
③为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,进行下列操作:
①加热 ②加入
 溶液 ③加入稀
溶液 ③加入稀 酸化 ④加入
酸化 ④加入 溶液
溶液下列操作顺序合理的是
a.①②③④ B.②③①④ C.④①③② d.①④②③
④在制备溴乙烷时,采用边反应边蒸出产物的方法,原因是
(4)性质比较
某同学用如图所示装置比较乙酸、苯酚、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊。
②
 中盛放的溶液是
中盛放的溶液是③苯酚钠溶液中发生反应的化学方程式为
您最近一年使用:0次
名校
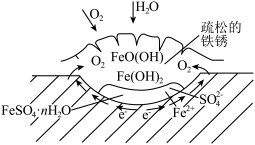
8 . 铁的化学性质比较活泼,能形成众多化合物,铁的合金是使用量最大的合金。铁制品易生锈,锈层内有硫酸盐时的腐蚀原理如图所示。 的价电子排布式为
的价电子排布式为___________ 。
(2) 的空间构型是
的空间构型是___________ ,图中属于非极性分子的是___________ (填化学式)。
(3)冰融化时需要克服的作用力类型是___________ 。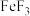 的熔点为1000℃,
的熔点为1000℃, 的熔点为200℃,则两种物质中的化学键类型
的熔点为200℃,则两种物质中的化学键类型___________ (填“相同”或“不同”)。
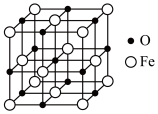
(4)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:___________ ,该氧化物的化学式为___________ 。
②设 表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 的价电子排布式为
的价电子排布式为(2)
 的空间构型是
的空间构型是(3)冰融化时需要克服的作用力类型是
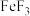 的熔点为1000℃,
的熔点为1000℃, 的熔点为200℃,则两种物质中的化学键类型
的熔点为200℃,则两种物质中的化学键类型(4)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:
②设
 表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
9 . 依据物质结构知识,回答下列问题。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为_______ 。
(2)根据价层电子对互斥理论,可以推知 白的空间构型为
白的空间构型为_______ ,其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为_______ 。
Ⅱ.H、C、N、O、S、Cl是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(3)H、C、N三种元素的电负性从小到大的顺序为_______ 。
(4)硫单质的一种结构为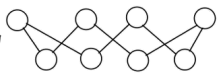 ,该物质
,该物质_______ (填“可溶”或“难溶”)于水。
(5)沸点:
_______ 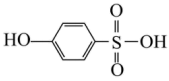 (填“>”或“<”),原因:
(填“>”或“<”),原因:_______ 。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
(2)根据价层电子对互斥理论,可以推知
 白的空间构型为
白的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为Ⅱ.H、C、N、O、S、Cl是非常重要的非金属元素,广泛存在于自然界。回答下列问题:
(3)H、C、N三种元素的电负性从小到大的顺序为
(4)硫单质的一种结构为
 ,该物质
,该物质(5)沸点:

 (填“>”或“<”),原因:
(填“>”或“<”),原因:
您最近一年使用:0次
名校
10 . 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是___________。
(2)硼酸( )溶液呈酸性,试写出其电离方程式:
)溶液呈酸性,试写出其电离方程式:___________ 。
(3)科学家对 结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
结构的认识经历了较为漫长的过程,最初,科学家提出了种观点: 与浓
与浓 反应生成
反应生成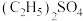 和水;
和水;
b.将制得的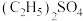 与
与 反应,只生成A和
反应,只生成A和 ;
;
c.将生成的A与 反应(已知该反应中
反应(已知该反应中 作还原剂)。
作还原剂)。
①如果 的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
的结构如甲所示,实验c中化学反应方程式为(A写结构简式)___________ 。
②为了进一步确定 的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:___________ 。
(1)下列粒子中可能存在配位键的是___________。
A. | B. | C. | D. |
(2)硼酸(
 )溶液呈酸性,试写出其电离方程式:
)溶液呈酸性,试写出其电离方程式:(3)科学家对
 结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:甲: 、乙:
、乙: ,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究
,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究 的结构,设计并完成了下列实验:
的结构,设计并完成了下列实验:
 与浓
与浓 反应生成
反应生成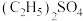 和水;
和水;b.将制得的
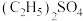 与
与 反应,只生成A和
反应,只生成A和 ;
;c.将生成的A与
 反应(已知该反应中
反应(已知该反应中 作还原剂)。
作还原剂)。①如果
 的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
的结构如甲所示,实验c中化学反应方程式为(A写结构简式)②为了进一步确定
 的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
您最近一年使用:0次



