名校
1 . (一)如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题:
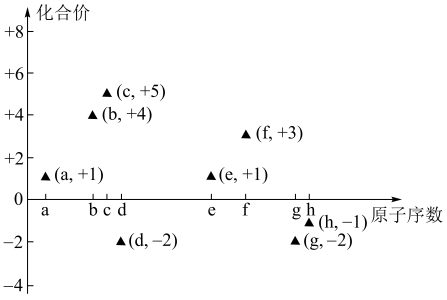
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式_____ ,乙分子类型属于____ 分子(填“极性”或“非极性”)。
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为_____ ,如果一次性取样分别检验上述反应的生成物,按照最简单的操作顺序写出所用试剂的名称_____ 。
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为_____ ,f元素的两种盐溶液也可以反应得到f元素最高价氧化物对应的水化物,该反应的离子方程式为_____ 。
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置_____ ,其价电子排布图为____ 。
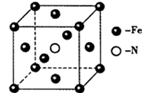
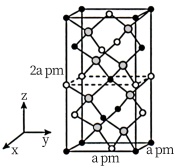
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为______ 。若该晶体的密度是ρg•cm-3,则两个最近的Fe原子间的距离为_____ cm。(用NA表示阿伏加德罗常数的值)
(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()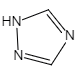 。
。
①配合物中阴离子的空间构型为_____ ,中心原子的杂化方式是_____ 。
② 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为______ 。
③1摩尔1,2,4—三氮唑最多能与_____ molH+结合。
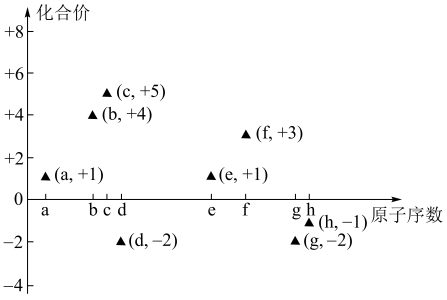
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为

(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()
 。
。①配合物中阴离子的空间构型为
②
 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为③1摩尔1,2,4—三氮唑最多能与
您最近半年使用:0次
2022-01-13更新
|
157次组卷
|
2卷引用:天津市耀华中学2021-2022学年高三上学期第二次月考化学试题
名校
2 . 铁、铜、钛、铝,钙等金属及其化合物在生活和工农业生产中有广泛应用。
(1)基态Ti原子的部分核外电子的轨道表达式有同学写成了以下形式: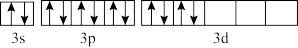 ,其原子核外电子排布违背了
,其原子核外电子排布违背了___________ 。用锌还原 的盐酸溶液,可制得绿色配合物[TiCl(H2O)5]Cl2∙H2O。1mol该配合物中含有σ键数目为
的盐酸溶液,可制得绿色配合物[TiCl(H2O)5]Cl2∙H2O。1mol该配合物中含有σ键数目为___________ 。
(2)画出Fe3+的外围电子排布图:________ ;向FeSe中嵌入吡啶 能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为_______ ,
(3)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因___________ ;
(4)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,熔融状态下的AlP不导电,其晶胞结构如图所示。

A、B点的原子坐标如图所示,则C点的原子坐标为___________ 。
(5)CaF2晶胞结构如下图

①晶体中距离最近的2个Ca2+(X) 与一个F-(Y)形成的夹角(∠XYX)为
与一个F-(Y)形成的夹角(∠XYX)为___________ 。
②CaF2的摩尔质量为78g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的Ca2+间中心距离为____ cm。
(1)基态Ti原子的部分核外电子的轨道表达式有同学写成了以下形式:
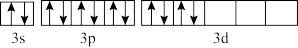 ,其原子核外电子排布违背了
,其原子核外电子排布违背了 的盐酸溶液,可制得绿色配合物[TiCl(H2O)5]Cl2∙H2O。1mol该配合物中含有σ键数目为
的盐酸溶液,可制得绿色配合物[TiCl(H2O)5]Cl2∙H2O。1mol该配合物中含有σ键数目为(2)画出Fe3+的外围电子排布图:
 能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为(3)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因
(4)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,熔融状态下的AlP不导电,其晶胞结构如图所示。

A、B点的原子坐标如图所示,则C点的原子坐标为
(5)CaF2晶胞结构如下图

①晶体中距离最近的2个Ca2+(X)
 与一个F-(Y)形成的夹角(∠XYX)为
与一个F-(Y)形成的夹角(∠XYX)为②CaF2的摩尔质量为78g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的Ca2+间中心距离为
您最近半年使用:0次
名校
3 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
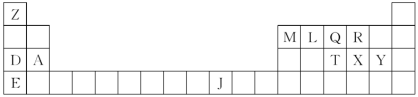
(1)Y分别与D、E形成的化合物中熔点较高的是_______ (用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是_________ (用元素符号表示)。
(2)LX2分子的电子式是______ ,XY2分子是_______ (填“极性分子”或“非极性分子”);
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J元素是______ 区的元素,J原子的核外电子排布式是_______ (基态);与配体微粒互为等电子体的离子是______ ;J(LR)4固态时属于_______ 晶体(填晶体类型)。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多种同分异构体(其中Q以三个单键与其他原子相连),请写出其中沸点最低的物质的结构简式:___________ 。
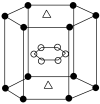
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高记录。如图所示的是该化合物的晶体结构单元(“●”、“△”代表A或M,晶胞内白色小球与此题无关。)。图中上下底面中心“△”处的原子是___________ (填元素符号)。

(1)Y分别与D、E形成的化合物中熔点较高的是
(2)LX2分子的电子式是
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J元素是
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多种同分异构体(其中Q以三个单键与其他原子相连),请写出其中沸点最低的物质的结构简式:
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高记录。如图所示的是该化合物的晶体结构单元(“●”、“△”代表A或M,晶胞内白色小球与此题无关。)。图中上下底面中心“△”处的原子是

您最近半年使用:0次
名校
4 . 钛是一种稀有金属,具有密度小、强度高、耐腐蚀等特点,钛和钛的化合物在航天、化工、建筑、日常生活中都有着广泛的用途。已知:阿伏加德罗常数的值为NA。
(1)基态钛原子价电子排布式为___________ 。
(2)钛的一种常见化合物是 。1mol该物质中含有σ键的数目为
。1mol该物质中含有σ键的数目为___________ ,配体H2O的VSEPR模型名称是___________ ,其沸点高于H2S,原因是___________
(3)常温下, 是易溶于
是易溶于 、易挥发的无色液体。
、易挥发的无色液体。 挥发过程中破坏的作用力类型是
挥发过程中破坏的作用力类型是___________
(4)氮化钛(TiN)晶体呈金黄色,化学稳定性好,可应用于超导材料。已知氮化钛晶体具有NaCl型结构,该晶体的晶胞参数为423.5pm,其晶体密度的计算表达式为___________ g/cm3。
(1)基态钛原子价电子排布式为
(2)钛的一种常见化合物是
 。1mol该物质中含有σ键的数目为
。1mol该物质中含有σ键的数目为(3)常温下,
 是易溶于
是易溶于 、易挥发的无色液体。
、易挥发的无色液体。 挥发过程中破坏的作用力类型是
挥发过程中破坏的作用力类型是(4)氮化钛(TiN)晶体呈金黄色,化学稳定性好,可应用于超导材料。已知氮化钛晶体具有NaCl型结构,该晶体的晶胞参数为423.5pm,其晶体密度的计算表达式为
您最近半年使用:0次
名校
5 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个 分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
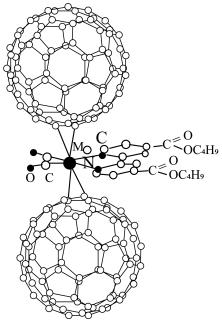
(1)Mo位于第5周期ⅥB族,基态原子核外电子排布与Cr相似,则基态Mo原子的价电子排布式为___________ 。
(2)该超分子中存在的化学键类型有___________(填字母)
(3)配体CO中提供孤电子对的原子是___________ (填元素符号);p—甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(4)从电负性角度解释 的酸性强于
的酸性强于 的原因
的原因___________ 。
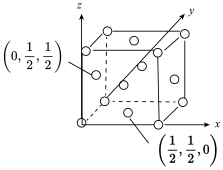
(5)已知:某晶胞中各原子的相对位置可用如图2所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是___________ 。已知该晶体的密度是 ,Mo的摩尔质量是
,Mo的摩尔质量是 ,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为___________ pm。
(6) 与金刚石互为同素异形体,从结构与性质之间的关系解释
与金刚石互为同素异形体,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是___________ 。金刚石晶胞含有___________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___________ a,列式表示碳原子在晶胞中的空间占有率___________ (列出表达式即可)。
 分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
(1)Mo位于第5周期ⅥB族,基态原子核外电子排布与Cr相似,则基态Mo原子的价电子排布式为
(2)该超分子中存在的化学键类型有___________(填字母)
| A.σ键 | B.π键 | C.离子键 | D.氢键 |
(4)从电负性角度解释
 的酸性强于
的酸性强于 的原因
的原因(5)已知:某晶胞中各原子的相对位置可用如图2所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是 ,Mo的摩尔质量是
,Mo的摩尔质量是 ,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
(6)
 与金刚石互为同素异形体,从结构与性质之间的关系解释
与金刚石互为同素异形体,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是
您最近半年使用:0次
名校
6 . 被称为“愚人金”的黄铜矿( )主要用作炼铜,其在野外很容易被误认为黄金。
)主要用作炼铜,其在野外很容易被误认为黄金。
(1)基态Cu原子中,核外电子占据最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 。
(2)基态硫原子的价层电子排布图是___________ 。硫单质的一种结构称被为“王冠结构” ,分子中S原子的杂化方式为
,分子中S原子的杂化方式为___________ ,该物质___________ (填“可溶”或“难溶”)于水。
(3)S有+4和+6两种价态的氧化物,关于气态 和
和 的说法中,正确的是___________(填字母)。
的说法中,正确的是___________(填字母)。
(4)三种离子① 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是___________ (用序号表示)。
(5)分析比较沸点高低:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 )主要用作炼铜,其在野外很容易被误认为黄金。
)主要用作炼铜,其在野外很容易被误认为黄金。(1)基态Cu原子中,核外电子占据最高能层的符号是
(2)基态硫原子的价层电子排布图是
 ,分子中S原子的杂化方式为
,分子中S原子的杂化方式为(3)S有+4和+6两种价态的氧化物,关于气态
 和
和 的说法中,正确的是___________(填字母)。
的说法中,正确的是___________(填字母)。| A.中心原子的价层电子对数目相等 | B.都含有极性键 |
| C.中心原子的孤电子对数目相等 | D.都是极性分子 |
 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是(5)分析比较沸点高低:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
您最近半年使用:0次
解题方法
7 . 硒—钴—镧(La)三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
(1)钴位于元素周期表中___ (填“s”、“p”、“d”或“ds”)区,与钴位于同一周期且含有相同未成对电子数的元素为__ (填元素符号)。
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中碳原子的杂化类型为___ ,元素Se、O、N的第一电离能由大到小的顺序___ 。

(3)硒的某种氧化物为链状聚合结构(如图2所示),该氧化物的化学式为___ 。SeO3的立体构型为___ 。

(4)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。已知光的波长与键能成反比,则图中实现光响应的波长:λ1___ (填“>”、“<”或“=”)λ2,其原因是___ 。

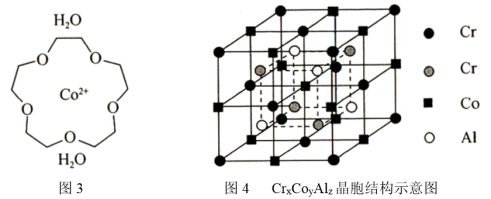
(5)[Co(15—冠—5)(H2O2)2+](“15一冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图3,该配位离子中含有的σ键数目为___ 。全惠斯勒合金CrxCoyAlz的晶胞结构如图4所示,其化学式为___ 。
(6)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,该合金的晶胞结构和z轴方向的投影图如图所示。

若阿伏加德罗常数的值为NA,则该合金的密度ρ=__ g·cm-3(用含a、c、NA的代数式表示,列出计算式即可)。
(1)钴位于元素周期表中
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中碳原子的杂化类型为

(3)硒的某种氧化物为链状聚合结构(如图2所示),该氧化物的化学式为

(4)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。已知光的波长与键能成反比,则图中实现光响应的波长:λ1

(5)[Co(15—冠—5)(H2O2)2+](“15一冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图3,该配位离子中含有的σ键数目为

(6)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,该合金的晶胞结构和z轴方向的投影图如图所示。

若阿伏加德罗常数的值为NA,则该合金的密度ρ=
您最近半年使用:0次
2022-01-08更新
|
449次组卷
|
2卷引用:河北省名校联盟2021-2022学年高三上学期一轮复习考试化学试题
解题方法
8 .  是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ 。
(2) 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 。常温常压下
。常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为___________ ,其固体的晶体类型为___________ 。
(3)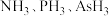 的沸点由高到低的顺序为
的沸点由高到低的顺序为___________ ,原因是___________ 。
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,
配合物的结构如图所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有___________  ,六元环中N原子的杂化方式为
,六元环中N原子的杂化方式为___________ 杂化。

(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系 的晶胞结构如下图所示,晶胞棱边夹角均为
的晶胞结构如下图所示,晶胞棱边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
一个晶胞中有___________ 个 ,其中,距离
,其中,距离 最近的
最近的 有
有 和
和
___________ (用坐标表示)。
 是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为(2)
 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 。常温常压下
。常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为(3)
 的沸点由高到低的顺序为
的沸点由高到低的顺序为(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,
配合物的结构如图所示, 该配合物中通过螯合作用形成的配位键有
该配合物中通过螯合作用形成的配位键有 ,六元环中N原子的杂化方式为
,六元环中N原子的杂化方式为
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系
 的晶胞结构如下图所示,晶胞棱边夹角均为
的晶胞结构如下图所示,晶胞棱边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。| 坐标 原子 | x | y | z |
 | 0 | 0 | 0 |
 | 0 | 0 | 0.5 |
 | 0.25 | 0.25 | 0.125 |

一个晶胞中有
 ,其中,距离
,其中,距离 最近的
最近的 有
有 和
和
您最近半年使用:0次
名校
解题方法
9 . KMnO4是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)基态Mn2+的核外电子排布式可表示为___________ ,上述反应方程式中的各原子的电负性由大到小的关系是___________ 。
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为___________ 。
(3)CO2的电子式是___________ ,C2O 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是___________ 。
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点由高到低顺序是___________ ,原因是___________ 。
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
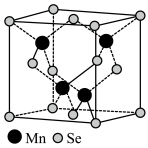
①β—MnSe中Mn的配位数为___________ 。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为___________ pm。
 +2MnO
+2MnO +16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:(1)基态Mn2+的核外电子排布式可表示为
(2)1mol[Mn(H2O)6]2+中所含有的共价键数目为
(3)CO2的电子式是
 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是(4)同主族元素氧、硫、硒对应最简单氢化物的沸点由高到低顺序是
(5)β—MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。

①β—MnSe中Mn的配位数为
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
您最近半年使用:0次
10 . 氮化物在工农业生产和日常生活中有着广泛应用,如TiN可用作熔盐电解的电极和电触头,NaN3应用在汽车气囊中。
(1)Ti元素位于元素周期表的位置为__________ 族,基态Ti原子的未成对电子数为__________ 。
(2)前10号元素中,第一电离能比N大的元素有__________ 。(填元素符号)
(3)与 互为等电子体的分子为
互为等电子体的分子为__________ 。
(4)C3N4晶体和金刚石结构类似,金刚石的熔点__________ C3N4的熔点(填大于或小于),原因是__________ 。
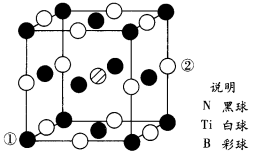
(5)用B掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的B有__________ 个,掺杂B后的晶体密度是TiN晶体的__________ 倍(保留小数点后两位)。已知掺杂后的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,原子①与原子②距离为__________ nm。
(1)Ti元素位于元素周期表的位置为
(2)前10号元素中,第一电离能比N大的元素有
(3)与
 互为等电子体的分子为
互为等电子体的分子为(4)C3N4晶体和金刚石结构类似,金刚石的熔点
(5)用B掺杂TiN后,其晶胞结构如下图所示,距离Ti最近的B有

您最近半年使用:0次



