名校
1 . 同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,不正确的是
| A.PH4I既有离子键又有共价键 | B.它是离子化合物 |
| C.它不可能与NaOH溶液反应 | D.它受热时,可能会分解产生气体 |
您最近一年使用:0次
2020-07-16更新
|
110次组卷
|
3卷引用:河北省元氏县第四中学2020-2021学年高二上学期期末考试化学试题
2 . 砷化硼 是一种具有超高热导率的新型半导体材料,其制备原理为
是一种具有超高热导率的新型半导体材料,其制备原理为 。下列说法错误的是( )
。下列说法错误的是( )

 是一种具有超高热导率的新型半导体材料,其制备原理为
是一种具有超高热导率的新型半导体材料,其制备原理为 。下列说法错误的是( )
。下列说法错误的是( )
A.图a表示 结构, 结构, 分子中成键电子对与孤电子对的数目之比为3:1 分子中成键电子对与孤电子对的数目之比为3:1 |
B.图b表示晶态单质硼 的基本结构单元,该基本结构单元为正二十面体 的基本结构单元,该基本结构单元为正二十面体 |
C.图c表示 晶胞结构, 晶胞结构, 原子的配位数为4 原子的配位数为4 |
| D.该反应所涉及的元素中,I的原子半径最大 |
您最近一年使用:0次
2020-07-15更新
|
164次组卷
|
3卷引用:湖北省蕲春县2020-2021学年高二下学期期中考试化学试题
2020·江苏·高考真题
3 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe基态核外电子排布式为___________ ; 中与Fe2+配位的原子是
中与Fe2+配位的原子是________ (填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________ ;C、N、O元素的第一电离能由大到小的顺序为_______________ 。
(3)与NH 互为等电子体的一种分子为
互为等电子体的一种分子为_______________ (填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________ mol。

(1)Fe基态核外电子排布式为
 中与Fe2+配位的原子是
中与Fe2+配位的原子是(2)NH3分子中氮原子的轨道杂化类型是
(3)与NH
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为

您最近一年使用:0次
2020-07-11更新
|
4533次组卷
|
10卷引用:解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题2020年江苏卷化学高考试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编山东省潍坊市临朐县实验中学2021届高三9月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年江苏卷化学高考真题变式题16-21(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题(已下线)结构与性质
2020·天津·高考真题
真题
解题方法
4 . Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_________ ,基态Fe原子的电子排布式为__________ 。
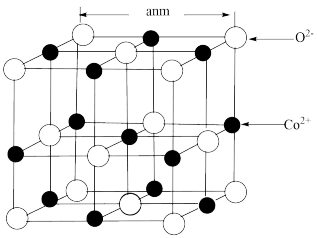
(2)CoO的面心立方晶胞如图所示。设阿伏加 德罗常数的值为NA,则CoO晶体的密度为______ g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______ 。
(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____ ,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:______ 。
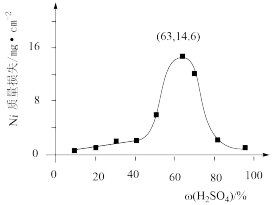
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当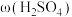 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____ 。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______ (填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______ 。
(1)Fe、Co、Ni在周期表中的位置为
(2)CoO的面心立方晶胞如图所示。设阿伏加 德罗常数的值为NA,则CoO晶体的密度为

(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当
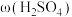 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
您最近一年使用:0次
2020-07-11更新
|
5093次组卷
|
7卷引用:解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练2020年天津卷化学高考试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年天津卷化学高考真题变式题1-12(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题20 结构与性质
2020·山东·高考真题
真题
名校
5 . B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是
| A.其熔点主要取决于所含化学键的键能 |
| B.形成大π键的电子全部由N提供 |
| C.分子中B和N的杂化方式相同 |
| D.分子中所有原子共平面 |
您最近一年使用:0次
2020-07-11更新
|
6603次组卷
|
32卷引用:专题11 物质结构与性质——备战2021年高考化学纠错笔记
(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题山东省滨州市无棣县2020-2021学年高二下学期期中考试化学试题(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第37讲 分子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)2020年山东省高考化学试卷(新高考)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编山东省济南市章丘区第四中学2021届高三上学期第一次教学质量检测(8月)化学试题山东潍坊高密一中2020-2021学年高二上学期12月化学月考试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)2020年山东卷化学高考真题变式题1-10(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)专题2 有机物的结构与分类 第一~二单元综合拔高练(已下线)第30讲 分子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)江西省景德镇一中2022-2023学年高二上学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第30讲 配合物 分子间作用力 超分子黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题北京师范大学附属实验中学2023届高三下学期三模化学试题(已下线)第3讲 化学键 共价键的类型及键参数北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题山西省运城市康杰中学2023-2024学年高二下学期开学考试化学试题
2020·浙江·高考真题
真题
名校
6 . 下列说法正确的是
A. 和 和 是两种不同的元素 是两种不同的元素 | B.单晶硅和石英互为同素异形体 |
C. 和 和 互为同系物 互为同系物 | D.H与 在元素周期表中处于同一主族 在元素周期表中处于同一主族 |
您最近一年使用:0次
2020-07-11更新
|
3471次组卷
|
17卷引用:解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)第15讲 原子结构 化学键(精讲)-2022年一轮复习讲练测(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题09.“四同”概念辨析-十年(2012-2021)高考化学真题分项汇编(浙江专用)海南省华中师范大学琼中附属中学2022届高三第二次月考化学试题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)海南省华师大琼中附中2021-2022学年高三上学期10月份月考化学试题2020年浙江省高考化学试卷(7月选考)(已下线)专题01 STSE 化学用语-2020年高考真题和模拟题化学分项汇编(已下线)第17讲 原子结构 化学键(精讲)——2021年高考化学一轮复习讲练测福建省长泰县第一中学2021届高三上学期11月考试化学试题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)第13讲 原子结构 化学键(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第13讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)化学预测卷(四)-预测卷(浙江专版)(已下线)专题11 常见的化学用语的书写及判断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
解题方法
7 . 快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:
(1)BF3+NH3=NH3·BF3的反应过程中,形成配位键时提供电子的原子是__ ,其提供的电子所在的轨道是__ 。
(2)基态Li+、B+分别失去一个电子时,需吸收更多能量的是__ ,理由是__ 。
(3)图1所示的晶体中,锂原子处于立方体的位置__ 。若其晶胞参数为apm,则晶胞密度为___ g·cm-3(列出计算式即可)。
(4)氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中,则每一个空隙由__ 个Cl-构成,空隙的空间形状为___ 。
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的 ,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x,如图3)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Cl-)=185pm, =1.4,
=1.4, =1.7。
=1.7。
①x=__ ,y=__ ;(保留一位小数)
②迁移可能性更大的途径是__ 。

(1)BF3+NH3=NH3·BF3的反应过程中,形成配位键时提供电子的原子是
(2)基态Li+、B+分别失去一个电子时,需吸收更多能量的是
(3)图1所示的晶体中,锂原子处于立方体的位置
(4)氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中,则每一个空隙由
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x,如图3)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Cl-)=185pm,
 =1.4,
=1.4, =1.7。
=1.7。①x=
②迁移可能性更大的途径是
您最近一年使用:0次
2020-07-10更新
|
220次组卷
|
2卷引用:山东省滕州市第一中学2021届高三下学期开学考化学试题
名校
解题方法
8 . 1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K____ Cr (填“>”或“<”)。
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为____ ;CrN 晶体类型与 NaCl 晶体相同,但前者熔点(1282℃)比后者(801℃)的高,主要原因是____ 。
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为_________ ,配体中采取sp3杂化的元素是__________ 。

(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。

①该氧化物的化学式为______ 。
②该晶胞有_____ %八面体空隙未填充阳离子。
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加 德罗常数的值,该晶体的密度为____ g·cm-3(用含a、b和NA的代数式表示)。
(1)Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为K
(2)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能,请写出Cr3+基态核外电子排布式为
(3)Cr3+可与很多分子或离子形成配合物, 如图配合物中 Cr3+的配位数为

(4)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如:CrA在O1、O2、O3、O4、O5、O6 构成的八面体空隙中)。

①该氧化物的化学式为
②该晶胞有
③已知氧离子半径a cm,晶胞的高为bcm,NA代表阿伏加 德罗常数的值,该晶体的密度为
您最近一年使用:0次
2020-07-09更新
|
397次组卷
|
2卷引用:河南省南阳市油田第一中学2021届高三五调考试化学试题
2020·山东青岛·三模
解题方法
9 . 亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解: 3K4[Fe(CN)6] 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是| A.Fe2+的最高能层电子排布为 3d6 |
| B.配合物K4[Fe(CN)6]中配位原子是碳原子 |
| C.(CN)2分子中σ键和π键数目比为 3:4 |
| D.已知 Fe3C 晶胞中每个碳原子被 6 个铁原子包围,则铁的配位数是 2 |
您最近一年使用:0次
2020-07-09更新
|
1969次组卷
|
8卷引用:解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省青岛市2020届高三第三次模拟化学试题河北省沧州市盐山县盐山中学2019-2020学年高二下学期期末考试化学试题(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练辽宁省大连市普兰店区第三十八中学2021届高三上学期第四次考试化学试题(已下线)基础卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)必刷卷01-2022年高考化学考前信息必刷卷(山东专用)全书综合测评-苏教版选择性必修2
2020·全国·高考真题
10 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________ ;金属离子与氧离子间的作用力为__________ ,Ca2+的配位数是__________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是__________ ;若晶胞参数为a nm,则晶体密度为_________ g·cm-3(列出计算式)。_______ 、_______ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是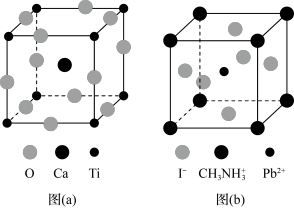
您最近一年使用:0次
2020-07-08更新
|
15310次组卷
|
21卷引用:专题11 物质结构与性质——备战2021年高考化学纠错笔记
(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题北京一零一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅱ化学真题变式题江西省九江市2022届第二次高考模拟统一考试理综化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题贵州省罗甸县边阳中学2022届高三模拟测试化学试题(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质四川省成都锦江区嘉祥外国语高级中学2023-2024学年高三下学期第一次诊断性考试理科综合试题-高中化学



