1 . 下列对有关事实的解释正确的是
| 事实 | 解释 | |
| A | 某些金属盐灼烧呈现不同焰色 | 电子从低能轨道跃迁至高能轨道时吸收光波长不同 |
| B | CH4与NH3分子的空间构型不同 | 二者中心原子杂化轨道类型不同 |
| C | HF的热稳定性比HCl强 | H-F比H-Cl的键能大 |
| D | SiO2的熔点比干冰高 | SiO2分子间的范德华力大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-10-12更新
|
4906次组卷
|
26卷引用:安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题
安徽省滁州市明光中学2020-2021学年高二下学期开学考试化学试题福建省福州高级中学2020-2021学年高二下学期期中考试化学试题福建省厦门市国祺中学2021-2022学年高三上学期第二次月考化学试题2020年海南省高考化学试卷(新高考)甘肃省高台县第一中学2021-2022学年高二下学期3月月考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)黑龙江省鸡西实验中学2021-2022学年高二下学期第一次月考化学试题重庆市朝阳中学2021-2022学年高二下学期期中考试化学试题福建省南平市高级中学2021-2022学年高二下学期期中考试化学试题山东省滨州市阳信县2021-2022学年高二下学期期中考试化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14抚顺市第一中学2021-2022学年高二下学期开学考试化学试题河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题江西省景德镇一中2022-2023学年高二上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题广东省东莞市东华高级中学2021-2022 学年高二下学期专题测试化学试题湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题(已下线)选择题6-10广东省惠州市实验中学2023-2024学年高二下学期3月月考化学试题广东省(深圳外国语学校、东莞东华高级中学、阳江一中、河源中学)2023-2024学年高二下学期阶段性考试化学试题广东省惠州市华罗庚中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 硼族元素及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子排布式为__________ ,B原子核外电子有_______ 个不同的能级。
(2)硼、铝同主族,晶体硼的熔点为2300℃,金属铝的熔点为660.3℃,试解释其原因:__________________________________________________ 。
(3)氨硼烷(NH3·BH3)是一种高性能新型储氢材料,其中硼原子的杂化方式为____________ 。三种元素的电负性由小到大顺序为________________ ,写出一种与氨硼烷互为等电子体的分子__________ (填化学式)。
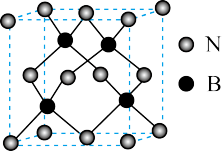
(4)氮化硼(BN)晶体是一种特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如下图所示。
①氮化硼晶体中六个面心的氮原子构成的几何形状为__________ 。
②已知立方氮化硼晶体中晶胞密度为d g·cm-3,阿伏加 德罗常数值为NA,则该晶体中距离最近的B原子与N原子之间的球心距离表达式为__________ nm。
(1)基态B原子的价电子排布式为
(2)硼、铝同主族,晶体硼的熔点为2300℃,金属铝的熔点为660.3℃,试解释其原因:
(3)氨硼烷(NH3·BH3)是一种高性能新型储氢材料,其中硼原子的杂化方式为
(4)氮化硼(BN)晶体是一种特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如下图所示。
①氮化硼晶体中六个面心的氮原子构成的几何形状为
②已知立方氮化硼晶体中晶胞密度为d g·cm-3,阿伏加 德罗常数值为NA,则该晶体中距离最近的B原子与N原子之间的球心距离表达式为

您最近一年使用:0次
2020-09-25更新
|
417次组卷
|
3卷引用:四川省仁寿第一中学校北校区2020-2021学年高二下学期期末模拟考试(6月月考)化学试题
名校
解题方法
3 . 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为________ ,基态O原子的电子占据了_____ 个能层,最高能级有_____ 种运动状态不同的电子。
(2)在CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol [Cu(CN)4]2-中含有的σ键的数目为______ 。
(3) [Cu(NH3)4]2+中,NH3中N原子的杂化方式是_____ 。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_____ (填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是__________ 。(填“平面正方形”或“正四面体”)
(4)NH3的沸点比N2O的沸点_____ (填“高”或“低”),其主要原因是___________ 。
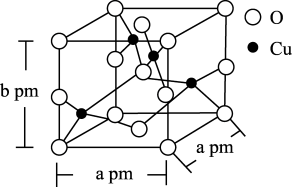
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是______ 。若该晶体结构为长方体,其参数如图,阿伏加 德罗常数为NA,则该氧化物的密度为_________ g/cm3。
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为
(2)在CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol [Cu(CN)4]2-中含有的σ键的数目为
(3) [Cu(NH3)4]2+中,NH3中N原子的杂化方式是
(4)NH3的沸点比N2O的沸点
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是

您最近一年使用:0次
2020-09-25更新
|
355次组卷
|
6卷引用:第6周 晚练题-备战2022年高考化学周测与晚练(新高考专用)
名校
4 . 元素是组成我们生活的世界中一切物质的“原材料”。
(1)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,到20世纪初,门捷列夫在周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量的递增呈现周期性变化,而是随着原子序数(核电荷数)的递增呈现周期性变化。其本质原因是________ (填标号)。
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(2)有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下相对于氢气的密度为35.5。其余元素的信息如图所示:

①上述七种元素中,处于第2周期的有________ (填元素符号),X在周期表中的位置是_________ 。
②E的原子结构示意图为_______ 。
③Y单质与X的最高价氧化物对应水化物反应的离子方程式为_____ 。
④B和D的最高价氧化物对应水化物的化学式分别为_______ 、_______ ,二者酸性前者_____ (填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:______ 。
(1)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,到20世纪初,门捷列夫在周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量的递增呈现周期性变化,而是随着原子序数(核电荷数)的递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(2)有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下相对于氢气的密度为35.5。其余元素的信息如图所示:

①上述七种元素中,处于第2周期的有
②E的原子结构示意图为
③Y单质与X的最高价氧化物对应水化物反应的离子方程式为
④B和D的最高价氧化物对应水化物的化学式分别为
您最近一年使用:0次
2020-09-24更新
|
638次组卷
|
4卷引用:北京市第二十中学2020-2021学年高一下学期期末考试化学试题
解题方法
5 .  、
、 等超导材料具有广阔的应用前景。
等超导材料具有广阔的应用前景。
(1)基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为__________ 。
(2)向 中嵌入吡啶(
中嵌入吡啶( )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________ ;该分子内存在________ (填标号)。
A 键 B
键 B  键 C 配位键 D 氢键
键 C 配位键 D 氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得 基超导材料
基超导材料 。
。
① 的空间构型为
的空间构型为__________ 。
②液氨是氨气液化的产物,氨气易液化的原因是___________ 。
③金属锂溶于液氨时发生反应: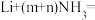 X
X 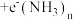 。X的化学式为
。X的化学式为__________ 。
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中 和
和 原子的投影位置如图2所示。
原子的投影位置如图2所示。
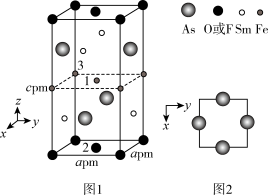
图中 和
和 共同占据晶胞的上下底面位置,若两者的比例依次用x和
共同占据晶胞的上下底面位置,若两者的比例依次用x和 代表,则该化合物的化学式表示为
代表,则该化合物的化学式表示为________________ ;通过测定密度 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
________  。
。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为 ,则原子2和3的坐标分别为
,则原子2和3的坐标分别为_____________ 、______________ 。
 、
、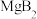 等超导材料具有广阔的应用前景。
等超导材料具有广阔的应用前景。(1)基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(2)向
 中嵌入吡啶(
中嵌入吡啶( )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为A
 键 B
键 B  键 C 配位键 D 氢键
键 C 配位键 D 氢键(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得
 基超导材料
基超导材料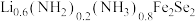 。
。①
 的空间构型为
的空间构型为②液氨是氨气液化的产物,氨气易液化的原因是
③金属锂溶于液氨时发生反应:
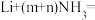 X
X 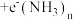 。X的化学式为
。X的化学式为(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中
 和
和 原子的投影位置如图2所示。
原子的投影位置如图2所示。
图中
 和
和 共同占据晶胞的上下底面位置,若两者的比例依次用x和
共同占据晶胞的上下底面位置,若两者的比例依次用x和 代表,则该化合物的化学式表示为
代表,则该化合物的化学式表示为 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
 。
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为
 ,则原子2和3的坐标分别为
,则原子2和3的坐标分别为
您最近一年使用:0次
2020-09-22更新
|
724次组卷
|
5卷引用:解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点35 晶体结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)广东省广州市执信、广雅、六中三校2021届高三上学期8月联考化学试题(已下线)考点48 晶体结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
解题方法
6 . 冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有_______ 种;基态铜原子的价电子排布图为_________ 。
(2)N和O中第一电离能较小的元素是__________ ;已知[Zn(NH3)4]2+的空间构型与 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________ ,NH3易液化的原因是_________________ 。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________ ,H2O2难溶于CCl4,其原因为________________ 。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________________ 。
(1)N元素原子核外电子云的形状有
(2)N和O中第一电离能较小的元素是
 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为
您最近一年使用:0次
解题方法
7 . 碳和磷的单质和化合物在科研与生产中有许多重要用途。石墨烯是碳原子排列成一种正六边形的单层平面网状结构(如下图),熔点约为4125K,强度高,韧性好,几乎透明。石墨烯材料是目前最薄、导电性最好的材料之一。


请回答下列问题:
(1)石墨烯中每个碳原子均采取__________ 杂化。
(2)石墨烯具有良好导电性的原因是__________________________________________ 。
(3)石墨烯的晶体类型为___________________ 。
(4)石墨烯可作锂离子电池的负极材料,正极材料可是Li3V2(PO4)3,在Li3V2(PO4)3中 的空间构型为
的空间构型为____________ ,Li、V、P三种元素第一电离能由大到小的顺序为_________________ 。
(5)V2+能与乙二胺形成配离子如图所示,该配离子中含有的化学键类型有______ (填字母)。
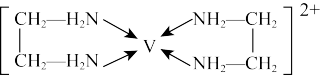
a.配位键 b.共价键 c.离子键 d.金属键
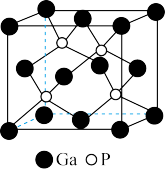
(6)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。
①镓的基态原子的价电子排布图是______________________ 。
②GaP的晶体结构如图所示,晶胞参数anm,该晶体中,两个磷原子之间的距离为__________ nm。GaP晶体的密度为(列出计算式)_________ g·cm-3。(NA为阿伏加 德罗常数的值)


请回答下列问题:
(1)石墨烯中每个碳原子均采取
(2)石墨烯具有良好导电性的原因是
(3)石墨烯的晶体类型为
(4)石墨烯可作锂离子电池的负极材料,正极材料可是Li3V2(PO4)3,在Li3V2(PO4)3中
 的空间构型为
的空间构型为(5)V2+能与乙二胺形成配离子如图所示,该配离子中含有的化学键类型有

a.配位键 b.共价键 c.离子键 d.金属键
(6)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。
①镓的基态原子的价电子排布图是
②GaP的晶体结构如图所示,晶胞参数anm,该晶体中,两个磷原子之间的距离为

您最近一年使用:0次
名校
解题方法
8 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为__________ ;[Fe(H2O)6]2+中与Fe2+配位的原子是_________ (填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是__________ ;C、N、O元素的第一电离能由大到小的顺序为__________ 。
(3)与 互为等电子体的一种分子为
互为等电子体的一种分子为__________ (填化学式)。
(4)柠檬酸的结构简式见图(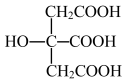 )。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
)。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为__________ NA。
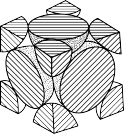
(5)经X射线衍射测定发现,晶体铁在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于__________ 。若该堆积方式下的晶胞参数为a cm,则铁原子的半径为_________ pm。
(1)Fe基态核外电子排布式为
(2)NH3分子中氮原子的轨道杂化类型是
(3)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式见图(
 )。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为
)。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为(5)经X射线衍射测定发现,晶体铁在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于

您最近一年使用:0次
2020-09-11更新
|
181次组卷
|
5卷引用:贵州省威宁阳光高级中学2022届高三第一次月考化学试题
名校
解题方法
9 . 鸟粪石[化学式为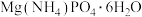 ]是一种盛产于秘鲁的优质氮磷肥料;钴(
]是一种盛产于秘鲁的优质氮磷肥料;钴( )是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素
② 不能长期稳定地存在
不能长期稳定地存在
③鸟粪石中金属阳离子的结构示意图为
④鸟粪石中2种阳离子的电子式分别为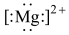 、
、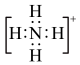
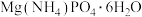 ]是一种盛产于秘鲁的优质氮磷肥料;钴(
]是一种盛产于秘鲁的优质氮磷肥料;钴( )是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是①钴不是主族元素
②
 不能长期稳定地存在
不能长期稳定地存在③鸟粪石中金属阳离子的结构示意图为

④鸟粪石中2种阳离子的电子式分别为
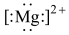 、
、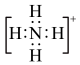
| A.①②③④ | B.①②③ | C.②③④ | D.①③④ |
您最近一年使用:0次
2020-09-06更新
|
356次组卷
|
3卷引用:重庆市杨家坪中学2020-2021学年高一上学期1月月考化学试题
解题方法
10 . 我国新报道的高温超导材料中,铊( )是其中重要的组成成分之一。已知铊与铝同主族,且位于元素周期表的第六周期,则下列关于铊的叙述错误的是
)是其中重要的组成成分之一。已知铊与铝同主族,且位于元素周期表的第六周期,则下列关于铊的叙述错误的是
 )是其中重要的组成成分之一。已知铊与铝同主族,且位于元素周期表的第六周期,则下列关于铊的叙述错误的是
)是其中重要的组成成分之一。已知铊与铝同主族,且位于元素周期表的第六周期,则下列关于铊的叙述错误的是| A.铊元素的原子半径大于铝元素的原子半径 |
| B.铊单质的固体硬度较小 |
C.铊的最高价氧化物对应的水化物为 |
| D.铊在空气中表面不易被氧化 |
您最近一年使用:0次
2020-09-06更新
|
294次组卷
|
3卷引用:4.1.3 原子结构与元素的性质-2021-2022学年高一化学课后培优练(人教版2019必修第一册)
(已下线)4.1.3 原子结构与元素的性质-2021-2022学年高一化学课后培优练(人教版2019必修第一册)人教版(2019)高一必修第一册第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 课时3 原子结构与元素的性质高一必修第一册(苏教2019版)专题5 课时3 碱金属元素与卤素



