名校
解题方法
1 . 现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
(1)C基态原子中能量最高的电子,其电子云在空间有__ 个方向,原子轨道呈__ 形,C简单离子核外有__ 种运动状态不同的电子。
(2)A2B2难溶于CS2,简要说明理由:__ 。
(3)G位于__ 族__ 区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为__ ;F晶体的空间堆积方式为__ 。
(4)ED3分子的VSEPR模型名称为__ ,其中E原子的杂化轨道类型为__ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数与s电子数相等 |
| C基态原子的价电子排布为nsn-1npn+1 |
| D的能层数与C相同,且电负性比C大 |
| E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第五列 |
(1)C基态原子中能量最高的电子,其电子云在空间有
(2)A2B2难溶于CS2,简要说明理由:
(3)G位于
(4)ED3分子的VSEPR模型名称为
您最近一年使用:0次
2 . 研究K、Ca、Fe、As、T等第四周期元素对生产、生活有重要意义。回答下列问题:
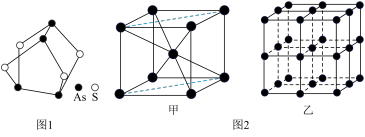
(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为___ ,砷酸常用于制备颜料、砷酸盐、杀虫剂等,则AsO 的空间构型是
的空间构型是___ 。
(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
①Ti3+的电子排布式为___ 。
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为___ ,原因是___ 。
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是___ 。(填字母标号)假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为___ g/cm3。(列式即可,设阿伏加 德罗常数的值为NA)


(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为
 的空间构型是
的空间构型是(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
①Ti3+的电子排布式为
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是

您最近一年使用:0次
名校
解题方法
3 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。
(1)Fe基态核外电子排布式为________ ;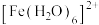 中与Fe2+配位的原子是
中与Fe2+配位的原子是______ (填元素符号)。
(2)H2O2是________ 分子(填“极性”“非极性”),电子式为_______ 。
(3)NH3分子中氮原子的轨道杂化类型是_______ ;C、N、O元素的第一电离能由大到小的顺序为___________ 。
(4)与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(5)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键为_________ mol。
(1)Fe基态核外电子排布式为
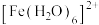 中与Fe2+配位的原子是
中与Fe2+配位的原子是(2)H2O2是
(3)NH3分子中氮原子的轨道杂化类型是
(4)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(5)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键为

您最近一年使用:0次
2020-08-27更新
|
78次组卷
|
2卷引用:陕西省宝鸡市渭滨中学2021届高三上学期第三次月考化学试题
4 . 离子液体是一种由离子组成的液体,在低温下也能以液态存在,是一种很有研究价值的溶剂。研究显示最常见的离子液体主要由如图所示正离子和负离子组成,图中正离子有令人惊奇的稳定性,它的电子在其环外结构中高度离域。下列说法不正确的是
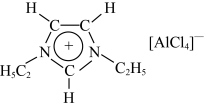
| A.该化合物中不存在配位键和氢键 |
| B.图中负离子的空间构型为正四面体形 |
| C.图中正离子中碳原子的杂化方式为sp2、sp3 |
| D.C、N、H三种元素的电负性由大到小的顺序为N>C>H |
您最近一年使用:0次
2020-08-26更新
|
523次组卷
|
7卷引用:解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练辽宁省葫芦岛市普通高中2020-2021学年高二下学期期末学业质量监测考试化学试题湖北省荆州市2019-2020学年高二下学期期末考试化学试题抚顺市第一中学2021-2022学年高二下学期开学考试化学试题山东省鄄城县第一中学2023-2024学年高二下学期3月月考化学试题山东省泰安第二中学2023-2024学年高二下学期3月月考化学试题云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
名校
5 . 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法错误的是( )
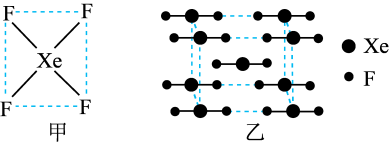

| A.XeF4是由极性键构成的非极性分子 |
| B.XeF2晶体属于分子晶体 |
| C.一个XeF2晶胞中实际拥有4个XeF2 |
D.XeF2晶体中距离最近的两个XeF2之间的距离为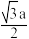 (a为晶胞边长) (a为晶胞边长) |
您最近一年使用:0次
2020-08-25更新
|
434次组卷
|
7卷引用:解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
名校
解题方法
6 . 许多元素及它们的化合物在科学研究和工业生产中具有许多用途。请回答下列有关问题:甲基呋喃与氨在高温下反应得到甲基吡咯:

(1)现代化学中,常利用____ 上的特征谱线来鉴定元素。与Zn同区、同周期元素基态原子的核外电子简化排布式是____ 。
(2)某同学画出基态碳原子的核外电子排布图: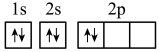 ,该电子排布图违背
,该电子排布图违背____ ;甲基呋喃和甲基吡咯所含的非金属元素中,电负性最大的是_____ ( 填元素符号)。
(3)由H、C、N形成的CH2=CHCN分子中碳原子轨道的杂化类型是____ ,1mol CH2=CHCN 分子中含π键的物质的量为_______ mol。
(4)配合物[Zn(NH3)3(H2O)]2+中与Zn2+形成配位键的原子是____ (填元素符号);与NH3分子互为等电子体的阳离子为_____ 。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如左下图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为__ 。
②磷化硼晶胞沿着体对角线方向的投影(图乙 中表示P原子的投影), 用
中表示P原子的投影), 用 画出B原子的投影位置
画出B原子的投影位置____ 。
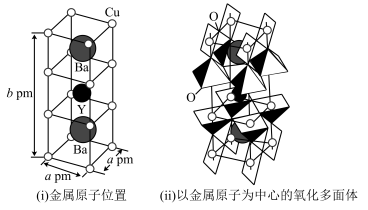
(6)如下图为铜与氧(O)、钇(Y)、 钡(Ba)形成的一种超导体材料的长方体晶胞结构,其晶胞参数如图(i)所示,该结构中有平面正方形(CuO4)和四方锥(CuO6)结构单元如图(ii)所示。
①该超导体材料的化学式为_______ 。
②已知该化合物的摩尔质量为Mg·mol-1,阿伏加 德罗常数的值为NA,其密度为___ 。


(1)现代化学中,常利用
(2)某同学画出基态碳原子的核外电子排布图:
 ,该电子排布图违背
,该电子排布图违背(3)由H、C、N形成的CH2=CHCN分子中碳原子轨道的杂化类型是
(4)配合物[Zn(NH3)3(H2O)]2+中与Zn2+形成配位键的原子是
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如左下图甲所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为
②磷化硼晶胞沿着体对角线方向的投影(图乙
 中表示P原子的投影), 用
中表示P原子的投影), 用 画出B原子的投影位置
画出B原子的投影位置(6)如下图为铜与氧(O)、钇(Y)、 钡(Ba)形成的一种超导体材料的长方体晶胞结构,其晶胞参数如图(i)所示,该结构中有平面正方形(CuO4)和四方锥(CuO6)结构单元如图(ii)所示。
①该超导体材料的化学式为
②已知该化合物的摩尔质量为Mg·mol-1,阿伏加 德罗常数的值为NA,其密度为


您最近一年使用:0次
2020-08-23更新
|
324次组卷
|
2卷引用:天津市第四十三中学2020-2021学年高一下学期期末考试化学试题
名校
7 . 2016年6月英国《自然 • 化学》杂志报道了一种结构新奇的含铍(Be)化合物,该化合物的化学式为BeL2,其中L是一个有机物分子,化合价为0。
(1)化合物BeL2中铍元素的化合价为_______ 。
(2)在一定条件下,BeLCl2、金属钾(K)和有机物L反应生成BeL2和KCl,该反应的化学方程式为________________ 。
(1)化合物BeL2中铍元素的化合价为
(2)在一定条件下,BeLCl2、金属钾(K)和有机物L反应生成BeL2和KCl,该反应的化学方程式为
您最近一年使用:0次
2020-08-23更新
|
56次组卷
|
4卷引用:广西靖西市第二中学2020-2021学年高二下学期期中水平考试化学试题
解题方法
8 . 有关雷酸(H—O—N C)和氰酸(H —O—C≡N)的说法错误的是
C)和氰酸(H —O—C≡N)的说法错误的是
 C)和氰酸(H —O—C≡N)的说法错误的是
C)和氰酸(H —O—C≡N)的说法错误的是| A.两者互为同分异构体 |
| B.元素电负性:O>N>C |
| C.物质中所含元素第一电离能:N>O>C |
| D.两种分子中的所有原子均在同一直线上 |
您最近一年使用:0次
2020-08-21更新
|
151次组卷
|
5卷引用:安徽省皖北名校2020-2021学年高二下学期第一次联考化学试题
名校
解题方法
9 . 陶瓷堪称是中国的国粹,对BN陶瓷叙述正确的是
| A.BN化合物中各原子均满足八电子结构 |
| B.B3+和N3-具有相同的核外电子排布 |
| C.若BN是空间网状结构,则其硬度与金刚石相似 |
| D.B3+的离子半径大于H-的半径 |
您最近一年使用:0次
2020-08-18更新
|
183次组卷
|
3卷引用:河北省保定市2020-2021学年高二上学期期末考试化学试题
名校
解题方法
10 . 镓与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____ ,基态As原子核外有_________ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓____ (填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_________ 。
GaF3的熔点超过1000℃,可能的原因是______ 。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为___ ,草酸根中碳原子的杂化方式为____ 。
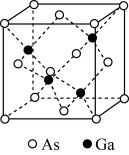

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_____ ,晶体的密度为____ (设NA为阿伏加 德罗常数的数值,列出算式即可)g·cm−3。
(1)基态Ga原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为


(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为
您最近一年使用:0次
2020-08-15更新
|
86次组卷
|
10卷引用:高二选择性必修2(人教版2019)全书综合训练
高二选择性必修2(人教版2019)全书综合训练河北省邢台市2018届高三上学期期末考试理综化学试题湖南省邵阳市2018届高三上学期期末考试理综化学试题山东省济南市章丘区2018届高三3月模拟联考理综化学试题山西省六校(长治二中,晋城一中、康杰中学、临汾一中等)2018届高三第四次名校联合考试(百日冲刺)理综化学试题四川省泸县第四中学2019届高三二诊模拟理综-化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二下学期第一次月考化学试题河北省藁城市第一中学2019届高三下学期4月月考化学试题河北省沧州市泊头市第一中学2020届高三上学期第四次月考化学试题湖南省湘潭一中、双峰一中,邵东一中2019-2020学年高二下学期联考化学试题



