名校
解题方法
1 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
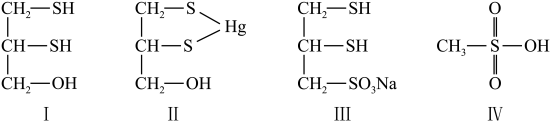
(4)基态硫原子价电子排布式为___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。

(4)基态硫原子价电子排布式为
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近半年使用:0次
名校
2 . 某晶体立方晶胞如图所示。已知图中微粒1的分数坐标是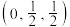 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法正确的是
。下列说法正确的是
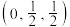 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。下列说法正确的是
。下列说法正确的是
A. 周围距离最近且相等的 周围距离最近且相等的 个数是6 个数是6 |
B.微粒2的分数坐标是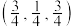 |
| C.已知银与铜位于同一族,银元素位于元素周期表的d区 |
D.若晶胞边长为a pm,则晶体密度为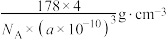 |
您最近半年使用:0次
2024-02-25更新
|
1085次组卷
|
5卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题广西柳州高中、南宁三中名校联盟2023-2024学年高三一轮复习诊断联考化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)选择题11-14安徽省蚌埠第二中学2023-2024学年高二下学期3月月考化学试题
解题方法
3 . 碳是一种很常见的元素,它能形成多种物质。
(1)碳与铁可以形成合金。
①基态碳原子的价电子排布图(即价电子轨道表示式)为___________ ;基态铁原子核外共有___________ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是___________ 。
(2)碳与其他元素一起能形成多种酸或酸根。
① 的空间构型是
的空间构型是___________ 。
②类卤素 分子中σ键与π键的数目比
分子中σ键与π键的数目比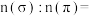
___________ 。 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(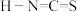 )的沸点,其原因是
)的沸点,其原因是___________ 。
(3)碳也可以形成多种有机化合物。
①有机物尿素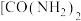 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为___________ 。
②吡咯(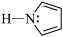 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为___________ ;分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为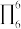 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为___________ 。
(4)碳还能形成多种同素异形体,如石墨、金刚石等。
①石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的K单质相互作用,形成某种青铜色的物质(其中的元素K用“●”表示),原子分布如图甲所示,该物质的化学式为___________ 。
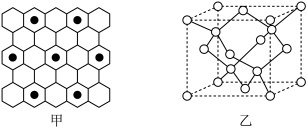
(图中的○表示碳形成的正四面体结构 )
)
②2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构——T-碳(如图乙)。已知T-碳密度为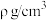 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则T-碳的晶胞参数
,则T-碳的晶胞参数
___________ pm(写出表达式即可)。
(1)碳与铁可以形成合金。
①基态碳原子的价电子排布图(即价电子轨道表示式)为
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是(2)碳与其他元素一起能形成多种酸或酸根。
①
 的空间构型是
的空间构型是②类卤素
 分子中σ键与π键的数目比
分子中σ键与π键的数目比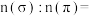
 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(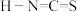 )的沸点,其原因是
)的沸点,其原因是(3)碳也可以形成多种有机化合物。
①有机物尿素
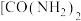 。尿素中C、N、O第一电离能大小顺序为
。尿素中C、N、O第一电离能大小顺序为②吡咯(
 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为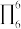 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为(4)碳还能形成多种同素异形体,如石墨、金刚石等。
①石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的K单质相互作用,形成某种青铜色的物质(其中的元素K用“●”表示),原子分布如图甲所示,该物质的化学式为

(图中的○表示碳形成的正四面体结构
 )
)②2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构——T-碳(如图乙)。已知T-碳密度为
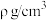 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则T-碳的晶胞参数
,则T-碳的晶胞参数
您最近半年使用:0次
名校
解题方法
4 . a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:下图甲表示的是这六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
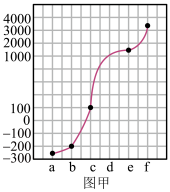
回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为___________ (用元素符号表示);
(2)元素b的单质的一个分子中含有___________ 个σ键和___________ 个π键;
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点___________ 乙的熔点(填>或<);
(4)元素d的基态原子的价电子排布式为___________ ;
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为___________ 丙的晶体类型为___________ ,在丙中,每个e原子周围最近的e原子数目为___________ 若晶胞参数为apm,则丙的密度表达式为___________ g・cm-3(用NA表示阿伏加德罗常数的值,丙的摩尔质量为Mg・mol-1)。
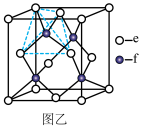

回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为
(2)元素b的单质的一个分子中含有
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点
(4)元素d的基态原子的价电子排布式为
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为

您最近半年使用:0次
5 . 2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子轨道表示式为___________ ,核外电子占据最高能级的电子云形状为___________ ;基态As原子最高能层上有___________ 个电子。
(2)镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________ ,砷的第一电离能比镓___________ (填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为___________ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为___________ ,AsH3分子的空间构型为___________ 。
(5)相同压强下,AsH3的沸点___________ NH3(填“大于”或“小于”),原因为___________ 。
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以___________ (填“共价键”或“离子键”)键合。设阿伏加德罗常数的值为NA,该晶胞边长为a pm则GaAs晶体的密度为___________ g•cm-3(列出计算式即可)。
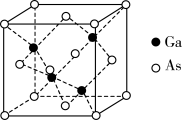
(1)基态Ga原子价电子轨道表示式为
(2)镓失去电子的逐级电离能(单位:kJ•mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为
(5)相同压强下,AsH3的沸点
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以

您最近半年使用:0次
6 . 氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为_______ 。
②C、N、O三种元素第一电离能从大到小的顺序是_______ 。
③下列说法正确的有_______ (不定项选择)。
A.C2H2、C2H4都是非极性分子 B.碳负离子CH 呈三角锥形
呈三角锥形
C.NO+电子式为 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子
(2)NaN3可用于汽车安全气囊。写出两种与N 互为等电子体的分子或离子
互为等电子体的分子或离子_______ 。
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有_______ ,1 mol该分子中含σ键的数目为_______ 。

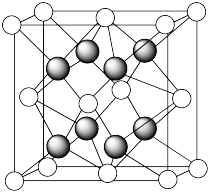
(4)CaF2的晶胞如图所示,若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶胞边长为_______ pm(用含ρ、NA的代数式表示)。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子 B.碳负离子CH
 呈三角锥形
呈三角锥形C.NO+电子式为
 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子(2)NaN3可用于汽车安全气囊。写出两种与N
 互为等电子体的分子或离子
互为等电子体的分子或离子(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

(4)CaF2的晶胞如图所示,若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶胞边长为

您最近半年使用:0次
解题方法
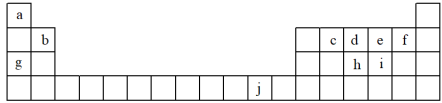
7 . 下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
回答下列相关问题:
(1)写出元素f简单离子的结构示意图_______ 。
(2)在c6a6分子中,元素c为_______ 杂化,该分子键角是_______ 。
(3)ci2分子的电子式为_______ ,ci2与ce2比较,沸点较高的是_______ (写分子式)。
(4)第一电离能:h_______ i;电负性:g_______ b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确的是_______ (填编号)。
①j位于元素周期表中第四周期、ⅠB族,属于ds区元素
②d的基态原子中,2p能级为半充满,属于p区元素
③最外层电子排布式为4s1,一定属于ⅠA族
④最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是_______ ,写出蓝色沉淀溶解在氨水中的离子方程式_______ 。

回答下列相关问题:
(1)写出元素f简单离子的结构示意图
(2)在c6a6分子中,元素c为
(3)ci2分子的电子式为
(4)第一电离能:h
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确的是
①j位于元素周期表中第四周期、ⅠB族,属于ds区元素
②d的基态原子中,2p能级为半充满,属于p区元素
③最外层电子排布式为4s1,一定属于ⅠA族
④最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是
您最近半年使用:0次
解题方法
8 . 三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3)SO2分子的 VSEPR模型名称为_______
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
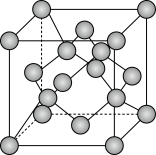
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为_______ cm。
(1)Cr的价电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)SO2分子的 VSEPR模型名称为
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为

您最近半年使用:0次
名校
解题方法
9 . Fe、Co、Ni是第四周期重要的金属元素,回答下列问题:
(1)基态 的价电子排布图为
的价电子排布图为_______ 。镍易形成 配合物,其熔点为-19.3℃,沸点为43℃,则其晶体类型是
配合物,其熔点为-19.3℃,沸点为43℃,则其晶体类型是_______ ,该配合物中三种元素电负性由大到小的顺序为_______ 。
(2)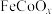 是一种新型光电催化剂,第四电离能大小关系是
是一种新型光电催化剂,第四电离能大小关系是
_______ 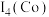 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是_______ 。
(3)二茂铁是一种具有芳香族性质的有机过渡金属化合物,其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯( )可用于制备二茂铁。
)可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为_______ 。
②1 mol环戊二烯中有_______ mol  键。
键。
(4) 晶体的晶胞如图甲所示。已知晶胞边长为a nm,阿伏加德罗常数的值为
晶体的晶胞如图甲所示。已知晶胞边长为a nm,阿伏加德罗常数的值为 ,该晶胞中
,该晶胞中 位于
位于 所形成的正八面体的体心,则晶胞密度为
所形成的正八面体的体心,则晶胞密度为_______  。
。
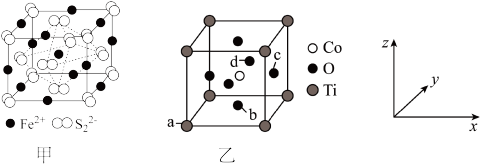
(5)钴的一种化合物晶胞结构如乙图所示。
已知a点的原子坐标参数为 ,b点为
,b点为 ,c点为
,c点为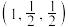 ,则d点的原子坐标参数为
,则d点的原子坐标参数为_______ 。
(1)基态
 的价电子排布图为
的价电子排布图为 配合物,其熔点为-19.3℃,沸点为43℃,则其晶体类型是
配合物,其熔点为-19.3℃,沸点为43℃,则其晶体类型是(2)
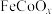 是一种新型光电催化剂,第四电离能大小关系是
是一种新型光电催化剂,第四电离能大小关系是
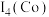 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(3)二茂铁是一种具有芳香族性质的有机过渡金属化合物,其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯(
 )可用于制备二茂铁。
)可用于制备二茂铁。①环戊二烯中碳原子的杂化方式为
②1 mol环戊二烯中有
 键。
键。(4)
 晶体的晶胞如图甲所示。已知晶胞边长为a nm,阿伏加德罗常数的值为
晶体的晶胞如图甲所示。已知晶胞边长为a nm,阿伏加德罗常数的值为 ,该晶胞中
,该晶胞中 位于
位于 所形成的正八面体的体心,则晶胞密度为
所形成的正八面体的体心,则晶胞密度为 。
。
(5)钴的一种化合物晶胞结构如乙图所示。
已知a点的原子坐标参数为
 ,b点为
,b点为 ,c点为
,c点为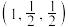 ,则d点的原子坐标参数为
,则d点的原子坐标参数为
您最近半年使用:0次
名校
解题方法
10 . 合成氨反应被誉为人类历史上最具跨时代意义的化学反应。
(1)比较大小(填写“>”或“<”):
①熔沸点:
_______  ②稳定性:
②稳定性:
_______  ③共价键的极性:
③共价键的极性:
_______ 
(2)合成氨工厂常用醋酸二氨合铜(由 和
和 构成)溶液吸收对氨合成催化剂有毒害的
构成)溶液吸收对氨合成催化剂有毒害的 气体。
气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是_______ 。
②醋酸二氨合铜所含的金属阳离子的价电子排布式为_______ 。
③在水溶液中, 离子比
离子比 稳定,常以
稳定,常以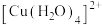 形式存在,向含
形式存在,向含 离子的溶液中加入氨水,可生成更稳定的
离子的溶液中加入氨水,可生成更稳定的 离子,其原因是
离子,其原因是_______ 。
(3) 与
与 气体相遇立即生成白色晶体:
气体相遇立即生成白色晶体: 。
。
①晶体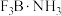 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为_______ 。
②写出一种与 具有相同空间构型的阴离子
具有相同空间构型的阴离子___ 。
(4)合成氨工业中,为了增大平衡时H2的转化率,可采取的措施是___ 。
A.增大压强 B.使用合适的催化剂 C.升高温度
D.增大氢气的浓度 E.及时分离出产物中的
(5)常温下,将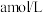 的氨水和
的氨水和 的稀盐酸等体积混合,溶液呈中性,则
的稀盐酸等体积混合,溶液呈中性,则
①混合前盐酸中 和氨水中
和氨水中 的关系
的关系
_______  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
②一水合氨的电离常数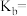
_______ 。
(1)比较大小(填写“>”或“<”):
①熔沸点:

 ②稳定性:
②稳定性:
 ③共价键的极性:
③共价键的极性:

(2)合成氨工厂常用醋酸二氨合铜(由
 和
和 构成)溶液吸收对氨合成催化剂有毒害的
构成)溶液吸收对氨合成催化剂有毒害的 气体。
气体。①醋酸二氨合铜所含的元素中,第一电离能最大的是
②醋酸二氨合铜所含的金属阳离子的价电子排布式为
③在水溶液中,
 离子比
离子比 稳定,常以
稳定,常以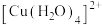 形式存在,向含
形式存在,向含 离子的溶液中加入氨水,可生成更稳定的
离子的溶液中加入氨水,可生成更稳定的 离子,其原因是
离子,其原因是(3)
 与
与 气体相遇立即生成白色晶体:
气体相遇立即生成白色晶体: 。
。①晶体
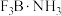 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为②写出一种与
 具有相同空间构型的阴离子
具有相同空间构型的阴离子(4)合成氨工业中,为了增大平衡时H2的转化率,可采取的措施是
A.增大压强 B.使用合适的催化剂 C.升高温度
D.增大氢气的浓度 E.及时分离出产物中的

(5)常温下,将
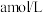 的氨水和
的氨水和 的稀盐酸等体积混合,溶液呈中性,则
的稀盐酸等体积混合,溶液呈中性,则①混合前盐酸中
 和氨水中
和氨水中 的关系
的关系
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。②一水合氨的电离常数
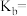
您最近半年使用:0次



