1 . 氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为_______ 。
②C、N、O三种元素第一电离能从大到小的顺序是_______ 。
③下列说法正确的有_______ (不定项选择)。
A.C2H2、C2H4都是非极性分子 B.碳负离子CH 呈三角锥形
呈三角锥形
C.NO+电子式为 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子
(2)NaN3可用于汽车安全气囊。写出两种与N 互为等电子体的分子或离子
互为等电子体的分子或离子_______ 。
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有_______ ,1 mol该分子中含σ键的数目为_______ 。

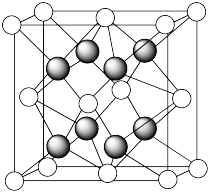
(4)CaF2的晶胞如图所示,若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶胞边长为_______ pm(用含ρ、NA的代数式表示)。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子 B.碳负离子CH
 呈三角锥形
呈三角锥形C.NO+电子式为
 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子(2)NaN3可用于汽车安全气囊。写出两种与N
 互为等电子体的分子或离子
互为等电子体的分子或离子(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

(4)CaF2的晶胞如图所示,若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶胞边长为

您最近半年使用:0次
解题方法
2 . 下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
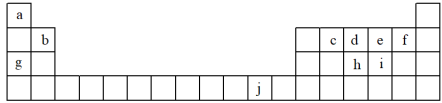
回答下列相关问题:
(1)写出元素f简单离子的结构示意图_______ 。
(2)在c6a6分子中,元素c为_______ 杂化,该分子键角是_______ 。
(3)ci2分子的电子式为_______ ,ci2与ce2比较,沸点较高的是_______ (写分子式)。
(4)第一电离能:h_______ i;电负性:g_______ b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确的是_______ (填编号)。
①j位于元素周期表中第四周期、ⅠB族,属于ds区元素
②d的基态原子中,2p能级为半充满,属于p区元素
③最外层电子排布式为4s1,一定属于ⅠA族
④最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是_______ ,写出蓝色沉淀溶解在氨水中的离子方程式_______ 。

回答下列相关问题:
(1)写出元素f简单离子的结构示意图
(2)在c6a6分子中,元素c为
(3)ci2分子的电子式为
(4)第一电离能:h
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确的是
①j位于元素周期表中第四周期、ⅠB族,属于ds区元素
②d的基态原子中,2p能级为半充满,属于p区元素
③最外层电子排布式为4s1,一定属于ⅠA族
④最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是
您最近半年使用:0次
解题方法
3 . 三价铬离子(Cr3+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。回答下列问题:
(1)Cr的价电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3)SO2分子的 VSEPR模型名称为_______
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
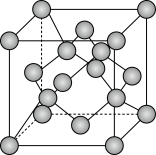
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为_______ cm。
(1)Cr的价电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)SO2分子的 VSEPR模型名称为
(4)化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该物质的配离子中提供孤电子对的原子为
(5)由碳元素形成的某种晶体的晶胞结构如图所示,若阿伏加德罗常数的值为NA,晶体密度为ρg/cm3,则该晶胞的棱长为

您最近半年使用:0次
解题方法
4 . 离子液体是一种由离子组成的液体,因具有许多独特的性质而成为当前科学研究的热点之一, 是一种离子液体(记为X)。
是一种离子液体(记为X)。
(1)基态氮原子的最高能级电子排布图为_______ ,[FeCl4]-中铁的M能层中电子运动状态有_______ 种。
(2)X离子液体中的碳原子杂化轨道类型为_______ ,该物质中不存在_______ (填字母标号)。
A. 离子键 B. 氢键 C.π键 D. 配位键
(3)已知氯化铁熔点为306℃,易溶解在甲醇、乙醇中,氟化铁熔点高于1000℃,不溶于甲醇、乙醇。氟化铁熔点远高于氯化铁的主要原因是_______ 。
(4)铁能形成多种氧化物,其中一种的晶胞结构如图所示:
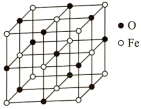
该氧化物的化学式为_______ ,若O、Fe原子半径分别为apm、bpm,Fe与O在晶体中紧密接触,晶体密度为ρg·cm-3,则阿伏加德罗常数NA=_______ mol-1,空间利用率为_______ (用含π、a、b的式子表示)。
(5)从1200K 降温到298K时,面心立方型的γ-Fe变化为体心立方型的δ-Fe,配位数_______ (填“变大” “不变” 或 “变小”)。假定降温时Fe原子半径不变,体积变为高温时的_______ 倍(保留3位有效数字,已知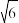 =2.45)。
=2.45)。
 是一种离子液体(记为X)。
是一种离子液体(记为X)。(1)基态氮原子的最高能级电子排布图为
(2)X离子液体中的碳原子杂化轨道类型为
A. 离子键 B. 氢键 C.π键 D. 配位键
(3)已知氯化铁熔点为306℃,易溶解在甲醇、乙醇中,氟化铁熔点高于1000℃,不溶于甲醇、乙醇。氟化铁熔点远高于氯化铁的主要原因是
(4)铁能形成多种氧化物,其中一种的晶胞结构如图所示:

该氧化物的化学式为
(5)从1200K 降温到298K时,面心立方型的γ-Fe变化为体心立方型的δ-Fe,配位数
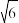 =2.45)。
=2.45)。
您最近半年使用:0次
解题方法
5 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_______ 。元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为_______ 和_______ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_______
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在_______ 。
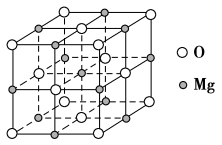
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为_______ nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为_______ nm。
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近半年使用:0次
名校
6 . 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素。其中A、B、C是同一周期的非金属元素。D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1) A、B、C第一电离能从大到小的顺序为_______ ;一种由B、C两种元素组成的粒子与AC2互为等电子体,其化学式为_______ 。
(2)ECl3与B、C的氢化物形成的配合物M的化学式为_______ ,配体数为_______ 。
(3)化合物N可视为两个B的氢化物分子各脱去一个氢原子后B原子间再成键的另一种B的氢化物,N能与硫酸反应生成B2H6SO4。B2H6SO4晶体类型与(BH4)2SO4相同,则B2H6SO4的晶体内不存在_______ (填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(4)D的立方晶胞如图所示,则每个D原子最近且距离相等的D原子个数为_______ ,若D原子半径为r cm,则该晶体的密度为 _______ g/cm3(已知:用含r、NA的代数式表示)。

(1) A、B、C第一电离能从大到小的顺序为
(2)ECl3与B、C的氢化物形成的配合物M的化学式为
(3)化合物N可视为两个B的氢化物分子各脱去一个氢原子后B原子间再成键的另一种B的氢化物,N能与硫酸反应生成B2H6SO4。B2H6SO4晶体类型与(BH4)2SO4相同,则B2H6SO4的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
(4)D的立方晶胞如图所示,则每个D原子最近且距离相等的D原子个数为

您最近半年使用:0次
解题方法
7 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____ 。元素Mn与O中,第一电离能较大的是____ ,基态原子核外未成对电子数较多的是____ 。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____ ,原因是____ 。
(3)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为____ nm。MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为____ nm。

(1)Co基态原子核外电子排布式为
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(3)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为

您最近半年使用:0次
8 . 回答下列问题:
(1)基态硅原子的电子排布式为____ ;基态铬原子的价电子排布图不能写成 形式,其原因是违背了
形式,其原因是违背了____ 。
(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为____ (填元素符号),灼烧硅酸铝钠时,当钠元素的价电子由____ (填“激发态”或“基态”)跃迁到另一状态时产生黄色火焰。
(3)1mol[Co(NH3)6]Cl2中含有σ键的数目为_____ NA,中心原子Co所在分区为_____ 区,价电子排布图为____ ;配体是分子_____ (填“极性”、“非极性”)。
(4)基态S原子电子占据最高能级的电子云轮廓图为____ 形,CS2的空间构型为_____ ,C2H5SH的沸点比C2H5OH低的原因____ 。
(5)Cu与O形成的一种化合物的立方晶胞如图所示:
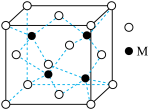
①M元素为____ ,该化合物的化学式为____ 。
②若该晶胞的边长为2nm,求该晶胞的密度____ g•cm-3。
(1)基态硅原子的电子排布式为
 形式,其原因是违背了
形式,其原因是违背了(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为
(3)1mol[Co(NH3)6]Cl2中含有σ键的数目为
(4)基态S原子电子占据最高能级的电子云轮廓图为
(5)Cu与O形成的一种化合物的立方晶胞如图所示:

①M元素为
②若该晶胞的边长为2nm,求该晶胞的密度
您最近半年使用:0次
名校
解题方法
9 . 下列关于Li、C、Al、S四种元素的说法错误的是
| A.元素Li、C的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素C与H形成的H2C=CH2分子中既含有极性键又含有非极性键 |
| C.已知AlCl3为共价化合物,则Al和Cl原子间形成的化学键为共价键 |
| D.元素S可与元素C形成共价化合物CS2 |
您最近半年使用:0次
2022-09-22更新
|
96次组卷
|
2卷引用:云南省文山州广南县第二中学2021-2022学年高一上学期12月月考化学试题
解题方法
10 . 铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为_______ ;
(2)已知:2UO2+5NH4HF2 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是_______ (填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的电负性由大到小的顺序是_______ (填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①分解产物中属于非极性分子的有_______ 。
②反应物中的 的空间构型为
的空间构型为_______ 。分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为_______ 。
(4)用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因_______ ;
(5)UO2的晶胞结构如图所示:

①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的_______ 空隙中。
②若两个氧原子间的最短距离为anm,则UO2晶体的密度为_______ g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
(1)基态氟原子的价电子排布图为
(2)已知:2UO2+5NH4HF2
 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑①NH4HF2中存在的微粒间的作用力是
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的电负性由大到小的顺序是
(3)已知:3(NH4)4[UO2(CO3)3]
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑①分解产物中属于非极性分子的有
②反应物中的
 的空间构型为
的空间构型为 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为(4)用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因
(5)UO2的晶胞结构如图所示:

①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的
②若两个氧原子间的最短距离为anm,则UO2晶体的密度为
您最近半年使用:0次



