名校
解题方法
1 . 下列关于Li、C、Al、S四种元素的说法错误的是
| A.元素Li、C的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素C与H形成的H2C=CH2分子中既含有极性键又含有非极性键 |
| C.已知AlCl3为共价化合物,则Al和Cl原子间形成的化学键为共价键 |
| D.元素S可与元素C形成共价化合物CS2 |
您最近一年使用:0次
2022-09-22更新
|
97次组卷
|
2卷引用:云南省文山州广南县第二中学2021-2022学年高一上学期12月月考化学试题
名校
解题方法
2 . 中科院苏州研究所研究成功新的5纳米激光光刻技术,有望打破阿斯美在这一领域的垄断,为国产芯片生产提供了契机。光刻胶的主要原料一般由C、H、O组成的大分子,回答下列问题:
(1)与C同周期的主族元素中,第一电离能最大的是__ (填元素符号,下同),电负性最小的是__ ,与基态C原子具有相同未成对电子数的元素是__ 。
(2)( )4—羟基二苯甲酮衍生物通常作为光刻技术的光引发剂,该分子中,C原子的杂化方式为
)4—羟基二苯甲酮衍生物通常作为光刻技术的光引发剂,该分子中,C原子的杂化方式为__ 。
(3)X是碳的一种氧化物,X的五聚合体结构如图所示,X分子中每个原子都满足最外层8电子结构,X分子的电子式为__ ,X分子中碳碳键的夹角为__ ,X的沸点__ CO2的沸点(填“大于”“小于”或“等于”),原因是__ 。

(4)有机卤化铅晶体具有独特的光电性能,其晶胞结构如图所示,若该晶胞的边长为anm,则最近的两个Cl-中心间的距离是__ ,在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于__ 位置。

(1)与C同周期的主族元素中,第一电离能最大的是
(2)(
 )4—羟基二苯甲酮衍生物通常作为光刻技术的光引发剂,该分子中,C原子的杂化方式为
)4—羟基二苯甲酮衍生物通常作为光刻技术的光引发剂,该分子中,C原子的杂化方式为(3)X是碳的一种氧化物,X的五聚合体结构如图所示,X分子中每个原子都满足最外层8电子结构,X分子的电子式为

(4)有机卤化铅晶体具有独特的光电性能,其晶胞结构如图所示,若该晶胞的边长为anm,则最近的两个Cl-中心间的距离是

您最近一年使用:0次
2021-12-16更新
|
530次组卷
|
2卷引用:云南省师范大学附属中学2021-2022学年上学期高三高考适应性月考卷(五)理科综合化学试题
名校
解题方法
3 . 含硼化合物有着重要的用途。回答下列问题:
(1)2021年7月,我国某科研团队发表论文,成果是合成3种二维过渡金属硼化物Mo2B2、Ti2B2、Cr2B2,该金属硼化物对CO2和N2在水溶液中电化学转化为尿素[CO(NH)2]具有很高的催化活性。
①基态B原子的电子排布式为_______ ;基态Ti原子核外占据最高能层电子的电子云轮廓图的形状为_______ 。
②C、N、O、H四种元素的电负性由大到小的顺序为_______ ,判断依据是_______ 。
③CO(NH2)2分子中,σ键与π键数目之比为_______ 。
(2)NaBH4是有机合成中常用的还原剂,BH 离子的空间构型为
离子的空间构型为_______ ,其中心原子的杂化轨道类型为_______ ,与BH 互为等电子体的一种阳离子为
互为等电子体的一种阳离子为_______ (填离子符号)。
(3)硼化钙可用于新型半导体材料,一种立方晶系硼化钙的晶胞结构如图所示。

该硼化钙的化学式为_______ ;若晶胞参数为a pm,晶体密度为ρg·cm-3, 则阿伏加德罗常数的值NA=_______ 。
(1)2021年7月,我国某科研团队发表论文,成果是合成3种二维过渡金属硼化物Mo2B2、Ti2B2、Cr2B2,该金属硼化物对CO2和N2在水溶液中电化学转化为尿素[CO(NH)2]具有很高的催化活性。
①基态B原子的电子排布式为
②C、N、O、H四种元素的电负性由大到小的顺序为
③CO(NH2)2分子中,σ键与π键数目之比为
(2)NaBH4是有机合成中常用的还原剂,BH
 离子的空间构型为
离子的空间构型为 互为等电子体的一种阳离子为
互为等电子体的一种阳离子为(3)硼化钙可用于新型半导体材料,一种立方晶系硼化钙的晶胞结构如图所示。

该硼化钙的化学式为
您最近一年使用:0次
名校
解题方法
4 . 第四周期过渡元素如铁、锰、铜、锌等在太阳能电池、磁性材料等科技方面有广泛的应用,回答下列问题:
(1)Fe 的基态原子共有_______ 种不同能级的电子。
(2)已知高温下CuO→Cu2O+O2从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是________ 。比较铁与锰的第三电离能(I3):铁______ 锰(填“>”“=”或“<”),原因是_________ 。
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有________ (填序号)。
a.离子键 b.共价键 c.配位键 d.氢键 e. 范德华力
②该离子中N原子的杂化类型有______
(4)图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
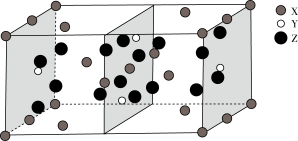
①已知化合物中Ge和O的原子个数比为1:4,图中Z表示_____ 原子(填元素符号),该化合物的化学式为____________ 。
②已知该晶胞的晶胞参数分别为a nm、b nm、 c nm,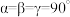 ,则该晶体的密度
,则该晶体的密度 =
=______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、 N、的代数式表示)。
(1)Fe 的基态原子共有
(2)已知高温下CuO→Cu2O+O2从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
(3)某含铜化合物的离子结构如图所示。

①该离子中存在的作用力有
a.离子键 b.共价键 c.配位键 d.氢键 e. 范德华力
②该离子中N原子的杂化类型有
(4)图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。

①已知化合物中Ge和O的原子个数比为1:4,图中Z表示
②已知该晶胞的晶胞参数分别为a nm、b nm、 c nm,
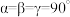 ,则该晶体的密度
,则该晶体的密度 =
=
您最近一年使用:0次
2021-10-20更新
|
426次组卷
|
2卷引用:云南省曲靖市第一中学2022届高三第一次质量监测卷理科综合化学试题
解题方法
5 . 纯碱和硅酸钠都属于碳族元素的含氧酸盐,性质既相似又不同。回答下列问题:
(1)纯碱中碳原子的杂化方式为_______ 。基态碳原子中未成对电子有_______ 个。
(2)某硅氧离子的空间结构示意图如图所示(虚线不表示共价键)。Si-O键的键角为_______ , 该硅氧离子的化学式为_______ 。该硅氧离子的钠盐溶液中存在的微粒间作用力类型有_______ (选填序号)。
A.范德华力 B.氢键 C.离子键 D.共价键

(3)硅烷数量、种类比烷烃_______ (填“多”或“少”);酸性: H2CO3_______ H2SiO3(填“>”、“<”或“=”),试解释酸性强弱的原因_______ 。
(4)单质硅的晶胞结构如图所示,已知单质硅的密度为ρg·cm-3,若NA是阿伏加德罗常数的值,则Si- Si 键的键长为_______ nm。(用含 N、ρ的代数式表示,列式即可,不用计算)

(1)纯碱中碳原子的杂化方式为
(2)某硅氧离子的空间结构示意图如图所示(虚线不表示共价键)。Si-O键的键角为
A.范德华力 B.氢键 C.离子键 D.共价键

(3)硅烷数量、种类比烷烃
(4)单质硅的晶胞结构如图所示,已知单质硅的密度为ρg·cm-3,若NA是阿伏加德罗常数的值,则Si- Si 键的键长为

您最近一年使用:0次
解题方法
6 . 砷化铝 (AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为___________ ;第一电离能I1(As)___________ I1(Se) (填“大于”或“小于”),其原因是___________ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为___________ ;分别指出分子中As、S原子的杂化轨道类型___________ 、___________ 。
(3)AlF3的熔点约为1040℃,AlCl3的熔点为194℃,其晶体类型分别是___________ 、___________ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。 ①上述致密保护膜是一种常见的氧化物,其化学式为
①上述致密保护膜是一种常见的氧化物,其化学式为___________ 。
②已知AlAs的立方晶胞如图2所示,其中As的配位数为___________ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为___________ pm。
(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1040℃,AlCl3的熔点为194℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
 ①上述致密保护膜是一种常见的氧化物,其化学式为
①上述致密保护膜是一种常见的氧化物,其化学式为②已知AlAs的立方晶胞如图2所示,其中As的配位数为
您最近一年使用:0次
名校
解题方法
7 . 化合物A是一种新型锅炉水除氧剂,其结构式如图所示: ,下列说法正确的是
,下列说法正确的是
| A.碳、氮原子的杂化类型相同 |
| B.氮原子与碳原子分别为sp3杂化与sp2杂化 |
| C.1 mol A分子中所含σ键的数目为10NA |
| D.编号为a的氮原子和与其成键的另外三个原子在同一平面内 |
您最近一年使用:0次
2021-07-09更新
|
197次组卷
|
2卷引用:云南省元阳县一中2020-2021学年高二下学期6月份考试化学试题
名校
解题方法
8 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)N2的电子式为___________
(2)砷在元素周期表中的位置___________ ,
(3)2017年5月9日,中国科学院发布了113号、115号、117号及118号四种元素的中文名称,其中镆元素的“镆”取自古代剑名“镆铘”,Mc的质子数为___________ 。
(4)已知:含1molP原子的白磷转化为黑磷要放出39.3kJ的能量;转化为红磷要放出17.6kJ的能量;由此推知,其中最稳定的磷单质是___________ 。(填物质名称)
(5)氮和磷氢化物性质的比较:热稳定性:NH3___________ PH3(填“>”或“<”),沸点:N2H4___________ P2H4(填“>”或“<”)
(6)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,写出PH3与HI反应产物的电子式___________ 。
(1)N2的电子式为
(2)砷在元素周期表中的位置
(3)2017年5月9日,中国科学院发布了113号、115号、117号及118号四种元素的中文名称,其中镆元素的“镆”取自古代剑名“镆铘”,Mc的质子数为
(4)已知:含1molP原子的白磷转化为黑磷要放出39.3kJ的能量;转化为红磷要放出17.6kJ的能量;由此推知,其中最稳定的磷单质是
(5)氮和磷氢化物性质的比较:热稳定性:NH3
(6)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,写出PH3与HI反应产物的电子式
您最近一年使用:0次
名校
9 . 氟代硼铍酸钾(含K、B、Be、O、F元素)晶体是唯一可直接倍频产生深紫外激光非线性光学晶体。回答下列问题:
(1)基态钾原子的核外电子排布式为___ ,B、Be、O的第一电离能从大到小的顺序是___ 。
(2)氟硼酸钾是制备氟代硼铍酸钾的原料之一,高温下分解为KF和BF3,氟硼酸钾晶体中所含的化学键有_____ (填序号)。
a.离子键 b.非极性键 c.极性键 d.配位键 e.金属键
(3)BF3易水解得到硼酸和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成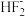 ,使酸性大大增强。
,使酸性大大增强。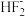 的结构式为
的结构式为____ ,BF3中除了含有σ键,还含有大π键,大π键可表示为___ 。写出一种与 互为等电子体的分子
互为等电子体的分子____ (写化学式)。
(4)如图甲所示是一种链式硼酸根离子的部分结构,则该硼酸根离子是_______ (填离子符号)。

(5)BeO晶体也是制备氟代硼铍酸钾的原料,图乙为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正正确描述投影结果的是____ (填序号)。

②设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为_ g·cm-3。
(1)基态钾原子的核外电子排布式为
(2)氟硼酸钾是制备氟代硼铍酸钾的原料之一,高温下分解为KF和BF3,氟硼酸钾晶体中所含的化学键有
a.离子键 b.非极性键 c.极性键 d.配位键 e.金属键
(3)BF3易水解得到硼酸和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成
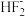 ,使酸性大大增强。
,使酸性大大增强。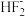 的结构式为
的结构式为 互为等电子体的分子
互为等电子体的分子(4)如图甲所示是一种链式硼酸根离子的部分结构,则该硼酸根离子是

(5)BeO晶体也是制备氟代硼铍酸钾的原料,图乙为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正正确描述投影结果的是

②设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为
您最近一年使用:0次
解题方法
10 . a、b、c、d、e、f、g、h八种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中b、c、d位于同一周期且相邻,e的原子半径是所有短周期主族元素中最大的.
请回答下列问题:
(1)a、d、e三种元素组成一种常见化合物,该化合物的电子式为___________ ,工业上利用某一个反应可同时生产该化合物和h的单质,写出该反应的化学方程式_____________________ 。
(2)c的单质分子 中有3个共价键,f是一种重要的半导体材料,c与f能形成一种新型无机非金属材料X,则X的化学式为
中有3个共价键,f是一种重要的半导体材料,c与f能形成一种新型无机非金属材料X,则X的化学式为___________________ 。
(3)在 的密闭容器中,通入
的密闭容器中,通入 气体和
气体和 气体,一定温度下反应后生成
气体,一定温度下反应后生成 气体,当反应达到平衡时,d2的浓度为
气体,当反应达到平衡时,d2的浓度为 ,则平衡时
,则平衡时 的转化率为
的转化率为___________ 。
(4)b的最简气态氢化物与h的气态单质在一定条件下发生反应,写出反应的化学方程式___________ 。
请回答下列问题:
(1)a、d、e三种元素组成一种常见化合物,该化合物的电子式为
(2)c的单质分子
 中有3个共价键,f是一种重要的半导体材料,c与f能形成一种新型无机非金属材料X,则X的化学式为
中有3个共价键,f是一种重要的半导体材料,c与f能形成一种新型无机非金属材料X,则X的化学式为(3)在
 的密闭容器中,通入
的密闭容器中,通入 气体和
气体和 气体,一定温度下反应后生成
气体,一定温度下反应后生成 气体,当反应达到平衡时,d2的浓度为
气体,当反应达到平衡时,d2的浓度为 ,则平衡时
,则平衡时 的转化率为
的转化率为(4)b的最简气态氢化物与h的气态单质在一定条件下发生反应,写出反应的化学方程式
您最近一年使用:0次
2021-06-11更新
|
408次组卷
|
2卷引用:云南省临沧市双江县2021-2022学年高一上学期9月月考化学试题



