名校
解题方法
1 . 浙江师范大学的研究团队研究获得了一类具有高活性和选择性的钙钛矿光催化剂(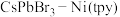 ),这一成果发表在2020年1月Chem Mater上。带有负电荷的CsPbBr3将带正电的
),这一成果发表在2020年1月Chem Mater上。带有负电荷的CsPbBr3将带正电的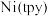 固定在其表面,用于可见光驱动CO2还原。
固定在其表面,用于可见光驱动CO2还原。

(1)写出Ni基态原子的价电子排布图___________ 。C原子核外电子有5种空间运动状态,则该原子处于___________ (填“基态”或“激发态”)。
(2)Ni(tpy)是二价阳离子,该离子中氮原子的杂化类型为___________ ,该离子结构中含有___________ (填字母)。
a.离子键 b.配位键 c.π键 d.氢键
(3)某些氧化物的熔点数据如下表所示:
解释表中氧化物之间熔点差异的原因___________
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是___________ kJ·mol-1,O2的键能是___________ kJ·mol-1,MnO的晶格能是___________ kJ·mol-1。
(5)钙钛矿是自然界中的一种常见矿物,其晶体属立方晶系,密度为ρg/cm3,某种钙钛矿的晶胞结构如图所示。

①NA为阿伏加德罗常数的值,晶胞中氧离子之间的最短距离为___________ cm(用含ρ和NA的代数式表示)。
②一种无金属钙钛矿MDABCO-NH4I3的晶胞结构与钙钛矿相同。若在MDABCO-NH4I3的晶胞中MDABCO的分数坐标为(0,0,0),I-的一种分数坐标为( ,
, ,0),则NH
,0),则NH 的分数坐标为
的分数坐标为___________ ,与MDABCO距离最近的I-有___________ 个。
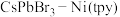 ),这一成果发表在2020年1月Chem Mater上。带有负电荷的CsPbBr3将带正电的
),这一成果发表在2020年1月Chem Mater上。带有负电荷的CsPbBr3将带正电的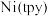 固定在其表面,用于可见光驱动CO2还原。
固定在其表面,用于可见光驱动CO2还原。
(1)写出Ni基态原子的价电子排布图
(2)Ni(tpy)是二价阳离子,该离子中氮原子的杂化类型为
a.离子键 b.配位键 c.π键 d.氢键
(3)某些氧化物的熔点数据如下表所示:
| 氧化物 | CO2 | Cs2O | PbO |
| 熔点/℃ | -56.6 | 490 | 888 |
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是
(5)钙钛矿是自然界中的一种常见矿物,其晶体属立方晶系,密度为ρg/cm3,某种钙钛矿的晶胞结构如图所示。

①NA为阿伏加德罗常数的值,晶胞中氧离子之间的最短距离为
②一种无金属钙钛矿MDABCO-NH4I3的晶胞结构与钙钛矿相同。若在MDABCO-NH4I3的晶胞中MDABCO的分数坐标为(0,0,0),I-的一种分数坐标为(
 ,
, ,0),则NH
,0),则NH 的分数坐标为
的分数坐标为
您最近一年使用:0次
名校
解题方法
2 . 金属与非金属在生产,生活和科研中应用广泛。
(1)基态Cr原子的价电子排布式为___________ ;
(2)在CrCl3的水溶液中,一定条件下存在组成为[CrCl(H2O)5]2+的配离子而呈绿色。配离子中的中心离子的配位数为___________ ,其中所含有的非金属元素的电负性由小到大的顺序为___________ 。
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为___________ 。
(4)比较F和I的第一电离能大小,并说明理由:___________ 。
(5)Xe是第五周期的稀有气体元素,与F形成的XeF4中心原子的价层电子对数为___________ ,下列对XeF4中心原子杂化方式推断合理的是___________ (填标号)。
A.sp B.sp2 C.sp3d2 D.sp3d
(6)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有___________ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为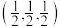 。已知Xe-F键长为r pm,则B点原子的分数坐标为
。已知Xe-F键长为r pm,则B点原子的分数坐标为___________ ;晶胞中A、B间距离d=___________ pm。

(1)基态Cr原子的价电子排布式为
(2)在CrCl3的水溶液中,一定条件下存在组成为[CrCl(H2O)5]2+的配离子而呈绿色。配离子中的中心离子的配位数为
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为(4)比较F和I的第一电离能大小,并说明理由:
(5)Xe是第五周期的稀有气体元素,与F形成的XeF4中心原子的价层电子对数为
A.sp B.sp2 C.sp3d2 D.sp3d
(6)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
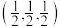 。已知Xe-F键长为r pm,则B点原子的分数坐标为
。已知Xe-F键长为r pm,则B点原子的分数坐标为
您最近一年使用:0次
3 . 氢(H),氧(O),硅(Si),钠(Na),镁(Mg),铝(Al),钾(K),钙(Ca),钛(Ti),铁(Fe),是地壳中含量前十的元素,请回答下列有关问题:
(1)依据原子核外电子排布,可将元素周期表分为_______ 个区,按此标准分类,上述十种元素可分为_______ (填数字)类,其中属于s区的元素有_______ (填元素符号)。
(2)地壳中含量最多的金属元素是_______ (填元素符号),其基态原子的电子排布式为_______ 。
(3)上述十种元素中,非金属元素的电负性从小到大的排列顺序为_______ (填元素符号);某激发态氢原子核外电子排布式为2p1,由该激发态跃迁到基态时,其原子发射光谱中能得到_______ 条谱线。
(1)依据原子核外电子排布,可将元素周期表分为
(2)地壳中含量最多的金属元素是
(3)上述十种元素中,非金属元素的电负性从小到大的排列顺序为
您最近一年使用:0次
解题方法
4 . 高熵合金通常被定义为含有5种以上主要元素的固溶体,每种元素的摩尔比为5%~35%.这个概念已经扩展到创造熵稳定的功能材料中.此类材料有熵稳定高熵功能材料(Mg、Co、Ni、Cu、Zn的氧化物),以及尖晶石、碳化物和硅化物等.根据所学知识回答下列问题:
(1)镍及其化合物常用作有机合成的催化剂,如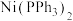 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为_______ ﹔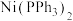 晶体中存在的化学键类型有
晶体中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(2)尖晶石是镁铝氧化物组成的矿物,含有铁,锌,锰等元素,Fe、Mn、Zn三种元素的第一电离能由大到小的顺序为_______ 。
(3)已知: 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成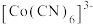 ,
, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_______ ,该离子中C的杂化方式为_______ 。
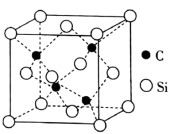
(4) 的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为
的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为_______ (用含a、b、 ,
, 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)镍及其化合物常用作有机合成的催化剂,如
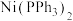 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为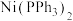 晶体中存在的化学键类型有
晶体中存在的化学键类型有A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(2)尖晶石是镁铝氧化物组成的矿物,含有铁,锌,锰等元素,Fe、Mn、Zn三种元素的第一电离能由大到小的顺序为
(3)已知:
 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成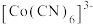 ,
, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为(4)
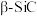 的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为
的晶胞结构如图所示,若碳和硅的原子半径分别为apm和bpm,密度为 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为 ,
, 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
5 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)现代化学中,常利用___________ 上的特征谱线来鉴定元素
(2)基态钴原子的价电子轨道表达式为___________ ,Mn位于元素周期表的___________ 区。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___________ 。PO 的空间构型是
的空间构型是___________ ,中心原子的杂化方式是___________ 。
(4)有些锂电池的负极锂嵌在石墨内,利用物质结构和性质解释含碳的两种微粒HCO 和CO
和CO 后者水解程度大的原因是
后者水解程度大的原因是___________ 。
(5)PH3是___________ 分子(填“极性”或“非极性”),其键角比NH3小,原因是___________ 。
(6)硫化锂Li2S(摩尔质量Mg∙mol−1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm−3,则距离最近的两个S2−的距离是___________ nm。(用含a、M、NA的计算式表示)

(1)现代化学中,常利用
(2)基态钴原子的价电子轨道表达式为
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是
 的空间构型是
的空间构型是(4)有些锂电池的负极锂嵌在石墨内,利用物质结构和性质解释含碳的两种微粒HCO
 和CO
和CO 后者水解程度大的原因是
后者水解程度大的原因是(5)PH3是
(6)硫化锂Li2S(摩尔质量Mg∙mol−1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm−3,则距离最近的两个S2−的距离是

您最近一年使用:0次
解题方法
6 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Z位于元素周期表____ (填周期和族),Y的氢化物的空间构型是___ 。
(2)XY2是一种常用的溶剂,XY2的分子中存在___ 个σ键。在H—Y、H—Z两种共价键中,键的极性较强的是___ ,键长较长的是____ 。
(3)写出W元素的原子核外电子排布式:_______ 。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表
(2)XY2是一种常用的溶剂,XY2的分子中存在
(3)写出W元素的原子核外电子排布式:
您最近一年使用:0次
名校
解题方法
7 . 三元锂电池性能优异、能量密度高,正极材料包含了Ni、Co、Mn三种过渡金属氧化物。
(1)基态Ni原子有__ 个未成对电子,Ni2+核外电子排布式为__ 。
(2)如表是Mn与Fe的部分电离能数据,解释I3(Mn)大于I3(Fe)的主要原因:__ 。
(3)已知[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-,写出该反应的离子方程式:__ ;1molCN-含有σ键的数目为__ ,该离子中C的杂化方式为__ 。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为__ 。
(5)Co与Ti类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为__ ,已知该晶胞的底边长为anm,高为cnm,则晶胞密度为__ g/cm3。(NA表示阿伏加德罗常数的值,列出代数式)

(1)基态Ni原子有
(2)如表是Mn与Fe的部分电离能数据,解释I3(Mn)大于I3(Fe)的主要原因:
| 元素 | Fe | Mn |
| 第二电离能I2(kJ/mol) | 1561 | 1509 |
| 第三电离能I3(kJ/mol) | 2957 | 3248 |
(3)已知[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-,写出该反应的离子方程式:
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为
(5)Co与Ti类似,其晶体堆积方式为六方最密堆积,其晶胞结构如图所示,则该晶胞中含有的原子个数为

您最近一年使用:0次
名校
8 . 顺铂的结构简式为 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题
。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题
(1)下列说法正确的是______
A.碳铂分子中有一个手性碳原子
B.顺铂与反铂化学键类型相同,分子的化学性质相同
C.碳铂的中心原子铂的配位数为4
D.[PtCl(NH3)2(H2O)]+中H2O的H原子与Pt形成配位键
(2)顺铂和反铂的物理性质有很大差异,其中只有_______ 易溶于水,原因是_______ 。
(3)NH3还能与很多化合物通过配位键发生相互作用。一种可作储氢材料的化合物X是NH3与第二周期另一种元素的氢化物通过化合反应形成配位键得到的产物,X是乙烷的等电子体;加热化合物X会缓慢释放出H2,并转化成化合物Y,Y是乙烯的等电子体。
①化合物X的结构式为_______ (必须标明配位键)。
②化合物X、Y中N原子分别采取_______ 杂化和_______ 杂化。
 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题
。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题(1)下列说法正确的是
A.碳铂分子中有一个手性碳原子
B.顺铂与反铂化学键类型相同,分子的化学性质相同
C.碳铂的中心原子铂的配位数为4
D.[PtCl(NH3)2(H2O)]+中H2O的H原子与Pt形成配位键
(2)顺铂和反铂的物理性质有很大差异,其中只有
(3)NH3还能与很多化合物通过配位键发生相互作用。一种可作储氢材料的化合物X是NH3与第二周期另一种元素的氢化物通过化合反应形成配位键得到的产物,X是乙烷的等电子体;加热化合物X会缓慢释放出H2,并转化成化合物Y,Y是乙烯的等电子体。
①化合物X的结构式为
②化合物X、Y中N原子分别采取
您最近一年使用:0次
名校
9 . 如图所示是元素周期表的一部分,表中所列字母分别代表一种元素。

试回答下列问题:
(1)以上元素中,属于d区元素的是_______ (填元素符号),元素k在周期表的位置是_______ 。
(2)画出c的核外电子排布图_______ ,这样排布遵循了构造原理、_______ 原理和_______ 规则。
(3)元素c的电负性_______ 元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是_______ (用元素符号表示);第三周期元素最高价氧化物对应的水化物中,酸性最强的是_______ (填化合物的化学式)。

试回答下列问题:
(1)以上元素中,属于d区元素的是
(2)画出c的核外电子排布图
(3)元素c的电负性
您最近一年使用:0次
名校
10 . 具有以下结构的原子一定属于p区元素的是
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④价电子有3个电子的原子
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④价电子有3个电子的原子
| A.②③ | B.①③ | C.②④ | D.①④ |
您最近一年使用:0次



