解题方法
1 . 离子液体是一种由离子组成的液体,因具有许多独特的性质而成为当前科学研究的热点之一, 是一种离子液体(记为X)。
是一种离子液体(记为X)。
(1)基态氮原子的最高能级电子排布图为_______ ,[FeCl4]-中铁的M能层中电子运动状态有_______ 种。
(2)X离子液体中的碳原子杂化轨道类型为_______ ,该物质中不存在_______ (填字母标号)。
A. 离子键 B. 氢键 C.π键 D. 配位键
(3)已知氯化铁熔点为306℃,易溶解在甲醇、乙醇中,氟化铁熔点高于1000℃,不溶于甲醇、乙醇。氟化铁熔点远高于氯化铁的主要原因是_______ 。
(4)铁能形成多种氧化物,其中一种的晶胞结构如图所示:
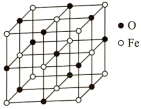
该氧化物的化学式为_______ ,若O、Fe原子半径分别为apm、bpm,Fe与O在晶体中紧密接触,晶体密度为ρg·cm-3,则阿伏加德罗常数NA=_______ mol-1,空间利用率为_______ (用含π、a、b的式子表示)。
(5)从1200K 降温到298K时,面心立方型的γ-Fe变化为体心立方型的δ-Fe,配位数_______ (填“变大” “不变” 或 “变小”)。假定降温时Fe原子半径不变,体积变为高温时的_______ 倍(保留3位有效数字,已知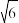 =2.45)。
=2.45)。
 是一种离子液体(记为X)。
是一种离子液体(记为X)。(1)基态氮原子的最高能级电子排布图为
(2)X离子液体中的碳原子杂化轨道类型为
A. 离子键 B. 氢键 C.π键 D. 配位键
(3)已知氯化铁熔点为306℃,易溶解在甲醇、乙醇中,氟化铁熔点高于1000℃,不溶于甲醇、乙醇。氟化铁熔点远高于氯化铁的主要原因是
(4)铁能形成多种氧化物,其中一种的晶胞结构如图所示:

该氧化物的化学式为
(5)从1200K 降温到298K时,面心立方型的γ-Fe变化为体心立方型的δ-Fe,配位数
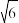 =2.45)。
=2.45)。
您最近一年使用:0次
名校
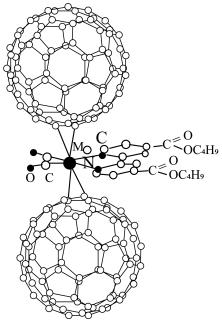
2 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个 分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
(1)Mo位于第5周期ⅥB族,基态原子核外电子排布与Cr相似,则基态Mo原子的价电子排布式为___________ 。
(2)该超分子中存在的化学键类型有___________(填字母)
(3)配体CO中提供孤电子对的原子是___________ (填元素符号);p—甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(4)从电负性角度解释 的酸性强于
的酸性强于 的原因
的原因___________ 。
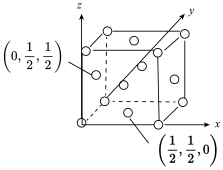
(5)已知:某晶胞中各原子的相对位置可用如图2所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是___________ 。已知该晶体的密度是 ,Mo的摩尔质量是
,Mo的摩尔质量是 ,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为___________ pm。
(6) 与金刚石互为同素异形体,从结构与性质之间的关系解释
与金刚石互为同素异形体,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是___________ 。金刚石晶胞含有___________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___________ a,列式表示碳原子在晶胞中的空间占有率___________ (列出表达式即可)。
 分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
分子、2个p一甲酸丁酯吡啶分子及2个CO分子利用配位键自组装的超分子结构如图1所示。
(1)Mo位于第5周期ⅥB族,基态原子核外电子排布与Cr相似,则基态Mo原子的价电子排布式为
(2)该超分子中存在的化学键类型有___________(填字母)
| A.σ键 | B.π键 | C.离子键 | D.氢键 |
(4)从电负性角度解释
 的酸性强于
的酸性强于 的原因
的原因(5)已知:某晶胞中各原子的相对位置可用如图2所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是 ,Mo的摩尔质量是
,Mo的摩尔质量是 ,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
,阿伏加德罗常数的值是NA,晶体中距离最近的Mo原子核之间的距离为
(6)
 与金刚石互为同素异形体,从结构与性质之间的关系解释
与金刚石互为同素异形体,从结构与性质之间的关系解释 的熔点远低于金刚石的原因是
的熔点远低于金刚石的原因是
您最近一年使用:0次
名校
3 . 被称为“愚人金”的黄铜矿( )主要用作炼铜,其在野外很容易被误认为黄金。
)主要用作炼铜,其在野外很容易被误认为黄金。
(1)基态Cu原子中,核外电子占据最高能层的符号是___________ ,占据该能层电子的电子云轮廓图形状为___________ 。
(2)基态硫原子的价层电子排布图是___________ 。硫单质的一种结构称被为“王冠结构” ,分子中S原子的杂化方式为
,分子中S原子的杂化方式为___________ ,该物质___________ (填“可溶”或“难溶”)于水。
(3)S有+4和+6两种价态的氧化物,关于气态 和
和 的说法中,正确的是___________(填字母)。
的说法中,正确的是___________(填字母)。
(4)三种离子① 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是___________ (用序号表示)。
(5)分析比较沸点高低:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 )主要用作炼铜,其在野外很容易被误认为黄金。
)主要用作炼铜,其在野外很容易被误认为黄金。(1)基态Cu原子中,核外电子占据最高能层的符号是
(2)基态硫原子的价层电子排布图是
 ,分子中S原子的杂化方式为
,分子中S原子的杂化方式为(3)S有+4和+6两种价态的氧化物,关于气态
 和
和 的说法中,正确的是___________(填字母)。
的说法中,正确的是___________(填字母)。| A.中心原子的价层电子对数目相等 | B.都含有极性键 |
| C.中心原子的孤电子对数目相等 | D.都是极性分子 |
 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是(5)分析比较沸点高低:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
您最近一年使用:0次
名校
解题方法
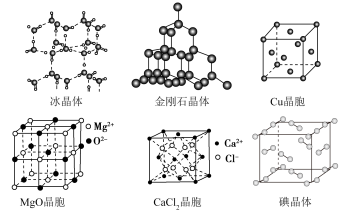
4 . 如图为几种晶体或晶胞的结构示意图。
(1)金刚石属于___________ 晶体,碘晶体属于___________ 晶体,每个碘晶胞中实际占有___________ 个碘分子,碘晶体熔化过程中克服的作用力为___________ 。
(2)①冰、②金刚石、③ 、④碘单质四种晶体的熔点由高到低的顺序为
、④碘单质四种晶体的熔点由高到低的顺序为___________ (填序号)。
(3) 晶胞与
晶胞与 晶胞结构相同,
晶胞结构相同, 晶体的熔点
晶体的熔点___________ (填“大于”或“小于”) 晶体的熔点,原因是
晶体的熔点,原因是___________ 。
(4)假设碘晶胞中立方体的边长为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则碘晶体的密度为
,则碘晶体的密度为___________  。
。
(1)金刚石属于
(2)①冰、②金刚石、③
 、④碘单质四种晶体的熔点由高到低的顺序为
、④碘单质四种晶体的熔点由高到低的顺序为(3)
 晶胞与
晶胞与 晶胞结构相同,
晶胞结构相同, 晶体的熔点
晶体的熔点 晶体的熔点,原因是
晶体的熔点,原因是(4)假设碘晶胞中立方体的边长为

 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则碘晶体的密度为
,则碘晶体的密度为 。
。
您最近一年使用:0次
2021-10-16更新
|
78次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2021-2022学年高二上学期第一次月考化学试题
名校
5 . I.硼酸盐有偏硼酸盐、原硼酸盐和多硼酸盐等多种,结构也较为复杂。但按照硼原子的配位数不同,可把硼酸盐中基本结构单元分为两类,即BO3结构单元和BO4结构单元,这些结构单元之间以链状或环状连接。
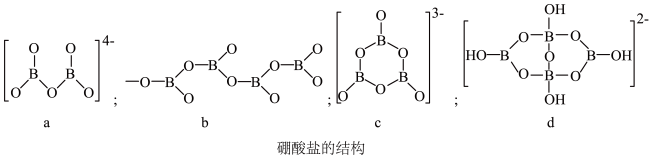
(1)图示a~d所示硼酸盐结构中,属于BO3结构单元的是___ (填图示序号),图b所示的结构简式为___ ;
(2)硼镁石是Mg2+与图a所示阴离子结构单元组成的五水合晶体,其化学式为____ ,硼原子的配位数为_____ ;
(3)硼酸钠(Na2B4O7·10H2O)俗称硼砂,硼砂晶体中阴离子[B4O5(OH)4]2-的结构如图d所示,其中硼原子的杂化方式为_____ ,该阴离子是一链状结构,则阴离子之间是以_____ 作用力结合。
(4)硼酸[B(OH)3]微溶于水,与水有微弱反应生成 而使其水溶液呈弱酸性,写出该反应方程式
而使其水溶液呈弱酸性,写出该反应方程式__ ,由此可知H3BO3是____ 元酸。
II.萤石的结构为立方单位晶胞,图-1为透视图;图-2为沿C轴投影,O为坐标原点。萤石的晶格参数a(单位nm),阿伏加德罗常数为NA
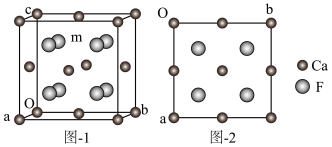
(1)萤石的密度d=_____ g/cm3
(2)若图-1中m原子的坐标为(1/4,1/4,3/4),写出与m原子配位的所有配位原子的坐标值(0,0,1);(1/2,1/2,1);_____ ,_____ 。在图-2中用符号“▽”标出m原子的投影____ 。

(1)图示a~d所示硼酸盐结构中,属于BO3结构单元的是
(2)硼镁石是Mg2+与图a所示阴离子结构单元组成的五水合晶体,其化学式为
(3)硼酸钠(Na2B4O7·10H2O)俗称硼砂,硼砂晶体中阴离子[B4O5(OH)4]2-的结构如图d所示,其中硼原子的杂化方式为
(4)硼酸[B(OH)3]微溶于水,与水有微弱反应生成
 而使其水溶液呈弱酸性,写出该反应方程式
而使其水溶液呈弱酸性,写出该反应方程式II.萤石的结构为立方单位晶胞,图-1为透视图;图-2为沿C轴投影,O为坐标原点。萤石的晶格参数a(单位nm),阿伏加德罗常数为NA

(1)萤石的密度d=
(2)若图-1中m原子的坐标为(1/4,1/4,3/4),写出与m原子配位的所有配位原子的坐标值(0,0,1);(1/2,1/2,1);
您最近一年使用:0次
名校
解题方法
6 . 现有八种物质:①干冰②碳化硅③氮化硼④晶体硫⑤过氧化钠⑥二氧化硅晶体⑦氯化铵⑧氖。请用编号填写下列空白。
(1)通过极性键形成的原子晶体是___________
(2)属于离子晶体的是___________
(3)一种离子晶体的晶胞如图,其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。①每个晶胞中含A离子的数目为
表示。①每个晶胞中含A离子的数目为___________ 。

②若A的核外电子排布与Ne相同,B的电子排布与Ar相同,则该离子化合物的化学式是___________ ;
③阳离子周围距离最近的阴离子数___________ 。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式。铁原子的配位数为___________ 。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为rpm,则其晶体密度为___________ g·cm-3(用含有r、NA的最简代数式表示)。
(1)通过极性键形成的原子晶体是
(2)属于离子晶体的是
(3)一种离子晶体的晶胞如图,其中阳离子A以
 表示,阴离子B以
表示,阴离子B以 表示。①每个晶胞中含A离子的数目为
表示。①每个晶胞中含A离子的数目为
②若A的核外电子排布与Ne相同,B的电子排布与Ar相同,则该离子化合物的化学式是
③阳离子周围距离最近的阴离子数
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式。铁原子的配位数为
②常见的金属铝采纳的是b堆积方式,铝原子的半径为rpm,则其晶体密度为
您最近一年使用:0次
名校
解题方法
7 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。
(1)Fe基态核外电子排布式为________ ;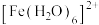 中与Fe2+配位的原子是
中与Fe2+配位的原子是______ (填元素符号)。
(2)H2O2是________ 分子(填“极性”“非极性”),电子式为_______ 。
(3)NH3分子中氮原子的轨道杂化类型是_______ ;C、N、O元素的第一电离能由大到小的顺序为___________ 。
(4)与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
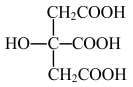
(5)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键为_________ mol。
(1)Fe基态核外电子排布式为
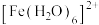 中与Fe2+配位的原子是
中与Fe2+配位的原子是(2)H2O2是
(3)NH3分子中氮原子的轨道杂化类型是
(4)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(5)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的σ键为

您最近一年使用:0次
2020-08-27更新
|
78次组卷
|
2卷引用:陕西省宝鸡市渭滨中学2021届高三上学期第三次月考化学试题
名校
解题方法
8 . 2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:____ ,其中电子占据的轨道数为_____ 个。
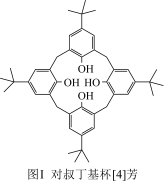
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____ ,羟基间的相互作用力为_____ 。
(3)不同大小的苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______ 。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:____ 。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于___ 晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_____ 。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为______ ,C60晶体密度的计算式为____ g·cm−3。(NA为阿伏伽德罗常数的值)
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:

(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为
(3)不同大小的苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为
您最近一年使用:0次
2019-03-25更新
|
937次组卷
|
6卷引用:陕西省西安市铁一中滨河高级中学2021-2022学年高三上学期第三次模拟考试理综化学试题
11-12高二下·山东济南·期中
名校
9 . 下列叙述中正确的是( )
| A.同一周期中,第ⅦA族元素的原子半径最大 |
| B.第ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.室温时,0族元素的单质都是气体 |
| D.同一周期中,碱金属元素的第一电离能最大 |
您最近一年使用:0次
2018-12-16更新
|
120次组卷
|
5卷引用:陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题
陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题福建省华安县第一中学2018-2019学年高二下学期第一次月考化学试题云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题(已下线)2011-2012年山东济南外国语学校高二下学期期中考试理科化学试卷云南省香格里拉县一中2018-2019学年高二上学期期中考试化学试题
名校
10 . 构成金属晶体的微粒是
| A.原子 | B.分子 | C.金属阳离子 | D.金属阳离子和自由电子 |
您最近一年使用:0次
2018-12-16更新
|
180次组卷
|
2卷引用:陕西省武功县普集高级中学2020-2021学年高二下学期第一次月考化学试题



